Порядок лицензирования фармацевтической деятельности
Данный подраздел официального сайта содержит информацию о порядке предоставления лицензии и порядке переоформления лицензии на осуществление фармацевтической деятельности.
Уважаемые соискатели лицензий и лицензиаты!
Управление Россельхознадзора по Тверской области информирует, что в соответствии с Постановлением Правительства Российской Федерации от 22.112.2011 № 1081 «О лицензировании фармацевтической деятельности» утвержден перечень выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность.
При подаче заявления о предоставлении лицензии на осуществление фармацевтической деятельности или заявления о переоформлении документа, подтверждающего наличие лицензии на осуществление фармацевтической деятельности в сфере обращения лекарственных средств для ветеринарного применения, соискатель лицензии (лицензиат) должен указывать «хранение лекарственных средств и препаратов для ветеринарного применения» помимо «Новые виды услуг и работ» кроме «розничной торговли лекарственными препаратами для ветеринарного применения». Другие работы и услуги необходимо указывать при намерении их осуществлять.
Другие работы и услуги необходимо указывать при намерении их осуществлять.
Для получения лицензии соискатель лицензии (юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий орган с заявлением о предоставлении лицензии) направляет или представляет в соответствующий лицензирующий орган:
* заявление о предоставлении лицензии по установленной форме, в котором указываются:
— полное и сокращенное наименование, в том числе фирменное наименование, и организационно-правовая форма юридического лица, адрес места нахождения, адреса мест осуществления лицензируемого вида деятельности, государственный регистрационный номер записи о создании юридического лица и данные документа, подтверждающего факт внесения сведений о юридическом лице в единый государственный реестр юридических лиц в ЕГРЮЛ, с указанием адреса место нахождения органа, осуществляющего государственную регистрацию, а также номера телефона и (в случае, если имеется) адреса электронной почты юридического лица;
— фамилия, имя, отчество индивидуального предпринимателя, адрес места его жительства, адреса мест осуществления лицензируемого вида деятельности, данные документа, удостоверяющего его личность, государственный регистрационный номер записи о государственной регистрации индивидуального предпринимателя, данные документа, подтверждающего факт внесения сведений об индивидуальном предпринимателе в ЕГРИП, с указанием адреса место нахождения органа, осуществляющего государственную регистрацию, а также номера телефона и (в случае, если имеется) адреса электронной почты индивидуального предпринимателя;
— идентификационный номер налогоплательщика и данные документа о постановке соискателя лицензии на учет в налоговом органе;
— лицензируемый вид деятельности, который соискатель лицензии намерен осуществлять.
* копии документов, подтверждающих наличие у соискателя лицензии на праве собственности или на ином законном основании использования помещений и оборудования, необходимых для осуществления лицензируемого вида деятельности;
* ДЛЯ РАБОТНИКОВ — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании и сертификатов специалистов, трудовые договоры.
ДЛЯ РУКОВОДИТЕЛЕЙ ОРГАНИЗАЦИИ (деятельность которого непосредственно связана с розничной торговлей лекарственными препаратами, их отпуском, хранением, перевозкой) — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании, документ, подтверждающий стаж работы по специальности не менее 3 лет, сертификат специалиста.
ДЛЯ ИНДИВИДУАЛЬНОГО ПРЕДПРИНИМАТЕЛЯ — копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании и сертификат специалиста.
* копия санитарно-эпидемиологического заключения о соответствии помещений требованиям санитарных правил.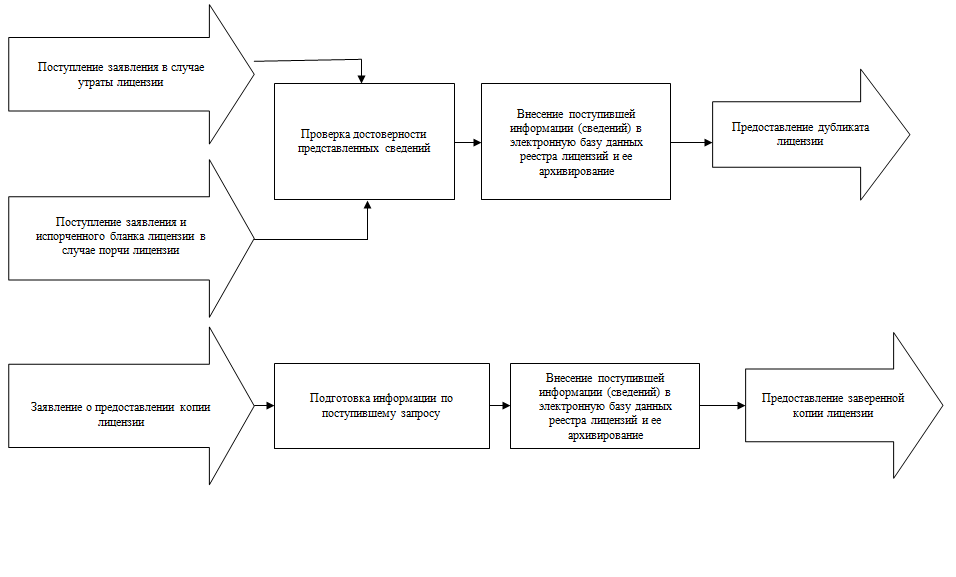
Заявление о предоставлении лицензии и прилагаемые к нему документы принимаются по описи.
Образец заявления о предоставлении лицензии Образец описи документов
Лицензия подлежит переоформлению в случаях реорганизации юридического лица в форме преобразования, изменения его наименования, адреса места нахождения, а также в случаях изменения места жительства, имени, фамилии, отчества индивидуального предпринимателя, реквизитов документа, удостоверяющего его личность, адресов мест осуществления юридическим лицом или индивидуальным предпринимателем лицензируемого вида деятельности, перечня выполняемых работ, оказываемых услуг, составляющих лицензируемый вид деятельности.
Для переоформления лицензии лицензиат представляет в лицензирующий орган, предоставивший лицензию, заявление о переоформлении лицензии, оригинал действующей лицензии, документ, подтверждающий уплату государственной пошлины за переоформление лицензии, документ, подтверждающий факт внесения соответствующих изменений в ЕГРЮЛ или ЕГРИП.
Заявление о предоставлении лицензии и прилагаемые к нему документы принимаются по описи.
Образец заявления о переоформлении лицензии Образец описи документов для переоформления лицензии
Федеральная служба по надзору в сфере здравоохранения
В соответствии с Федеральным законом от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», постановлением Правительства Российской Федерации от 21.11.2011 № 957 «Об организации лицензирования отдельных видов деятельности» Федеральная служба по надзору в сфере здравоохранения осуществляет лицензирование фармацевтической деятельности:
Росздравнадзор (Управление лицензирования и контроля соблюдения обязательных требований, отдел лицензирования фармацевтической деятельности и деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений и контроля в сфере обращения лекарственных средств) осуществляет лицензирование фармацевтической деятельности в части деятельности, осуществляемой организациями оптовой торговли лекарственными средствами для медицинского применения.
Территориальные органы Росздравнадзора по субъектам Российской Федерации осуществляют лицензирование фармацевтической деятельности в части деятельности, осуществляемой аптечными организациями, подведомственными федеральным органам исполнительной власти, государственным академиям наук.
Результатом предоставления государственной услуги по лицензированию деятельности является:
- предоставление (отказ в предоставлении) лицензии;
- переоформление (отказ в переоформлении) лицензии;
- выдача дубликата лицензии, копии лицензии;
- решение о приостановлении действия лицензий, о возобновлении действия лицензии, о прекращении действия лицензии и аннулировании лицензии;
- предоставление заявителям выписки из единого реестра лицензий.
Заявления и документы (копии документов), необходимые для получения или переоформления лицензии, могут быть представлены соискателем лицензии (лицензиатом) в форме электронного документа с использованием информационно-коммуникационных технологий, в том числе с использованием Единого портала государственных и муниципальных услуг: www. gosuslugi.ru.
gosuslugi.ru.
Основные задачи:
- Предоставление государственной услуги по лицензированию фармацевтической деятельности
- Предоставление государственной услуги осуществляется в соответствии с Федеральным законом от 04.05 2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» и Федеральным законом от 27 июля 2010 г. № 210-ФЗ «Об организации предоставления государственных и муниципальных услуг».
- Лицензионный контроль фармацевтической деятельности. Контроль за исполнением лицензионных требований осуществляется в соответствии с планом проверок, согласованным с Генеральной прокуратурой Российской Федерации, в соответствии с нормами Федерального закона от 26 декабря 2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля».
Смотреть весь текст
Скрыть часть текста
Статья 34.
 Лицензирование фармацевтической деятельности. (в ред. Федерального закона от 10.01.2003 N 15-ФЗ)
Лицензирование фармацевтической деятельности. (в ред. Федерального закона от 10.01.2003 N 15-ФЗ)1. Фармацевтическая деятельность подлежит лицензированию в соответствии с законодательством Российской Федерации.
2. Обязательными условиями для принятия решения о выдаче лицензии являются представление соискателем лицензий документов, подтверждающих право соискателя лицензии на использование помещений в целях осуществления фармацевтической деятельности, наличие сертификатов у специалистов, осуществляющих фармацевтическую деятельность, а также санитарно-эпидемиологического заключения о соответствии помещений требованиям санитарных правил.
Комментируемая статья регулирует порядок лицензирования фармацевтической деятельности.
Фармацевтическая деятельность подлежит лицензированию в соответствии с законодательством РФ.
Лицензирование фармацевтической деятельности регулируется положением о лицензировании фармацевтической деятельности.

Лицензирование деятельности аптечных учреждений и аптечных предприятий является способом контроля государства за соблюдением аптечными учреждениями требований законодательства, предъявляемых к их организационно-правовому статусу, фармацевтической деятельности, связанной с оказанием лекарственной помощи населению.
Лицензирование деятельности аптечных учреждений осуществляется в соответствии с законодательством о лекарственных средствах, нормативными и методическими документами, учрежденными органами государственного управления и Министерством здравоохранения и социального развития РФ.
Государственная лицензия на право заниматься фармацевтической деятельностью должна содержать:
1) полное наименование аптечного учреждения с указанием его организационно-правовой формы;
2) местонахождение аптечного учреждения;
3) разрешение на фармацевтическую деятельностью в системе лекарственного обеспечения населения;
5) дату занесения лицензии в реестр.

Лицензирование аптечных учреждений проводится при открытии новых аптечных учреждений, изменении аптечными учреждениями организационно-правовой формы и формы собственности, окончании срока действия выданной ранее лицензии.
Лицензированию подвергаются все виды фармацевтической деятельности, выполняемые аптечными учреждениями, в том числе:
1) изготовление всех видов лекарственных форм по рецептам врачей и требованиям лечебно-профилактических учреждений;
3) контроль за технологией изготовления, хранением, качеством готовых лекарственных средств и лекарств, изготовленных в аптеках;
4) лекарственного растительного сырья и препаратов из него;
5) получение, хранение, организация, доставка, отпуск лекарственных средств и изделий медицинского назначения в аптечные и лечебно-профилактические учреждения;
6) реализация населению и лечебно-профилактическим учреждениям лекарственных средств, как изготовленных в аптеках, так и готовых лекарственных средств и изделий медицинского назначения, разрешенных к применению в Российской Федерации.

Лицензирование может проводиться досрочно по инициативе аптечного учреждения с целью получения лицензии на новые виды лекарственной помощи и услуг по инициативе органов государственного управления в случае аннулирования или приостановления действия лицензии, по решению суда.
Для получения государственной лицензии аптечное учреждение представляет в лицензионную комиссию следующие документы:
1) заявление;
2) копию свидетельства о государственной регистрации учреждения;
3) копию устава или положения лицензируемого учреждения;
4) копию ордера или договора об аренде помещения, оборудования;
6) заключение государственного санитарного надзора;
7) заключение государственного пожарного надзора;
8) заключение о состоянии эксплуатации здания;
9) аккредитационные сертификаты аптечных учреждений и персонала;
10) копию ранее выданной лицензии;
11) копию платежного поручения об уплате единовременного сбора за выдачу лицензии.

Процедура лицензирования определяется комиссией и предусматривает изучение представленных аптечным учреждением документов, проведение экспертизы на местах и выдачу лицензии.
Аптечное учреждение, прошедшее лицензирование в установленном порядке, получает лицензию и протокол к лицензии на право заниматься фармацевтической деятельностью в заявленном объеме или обоснованный отказ в выдаче лицензии.
Срок действия лицензии устанавливается органом государственного управления.
Отзыв лицензии на право осуществления фармацевтической деятельности либо приостановление ее действия производится лицензионной комиссией по представлению аккредитационной комиссии и доводится до сведения аптечного учреждения в письменном виде.
1) нарушения аптечным учреждением действующего законодательства, нормативных и методических документов, утвержденных Министерством здравоохранения и социального развития РФ, определяющих порядок деятельности аптечных учреждений и требования к качеству лекарственной помощи, оказываемой населению, стандартов аптечных учреждений;
2) изменения устава и видов деятельности аптечного учреждения без перерегистрации в лицензионной комиссии.

До получения лицензии аптечное учреждение и физические лица, осуществляющие индивидуальную или коллективную деятельность в системе лекарственного обеспечения, должны пройти аккредитацию в соответствии с действующим в Российской Федерации порядком.
Лицензируемое аптечное учреждение обязано:
1) в установленные сроки подавать заявку и необходимые документы на проведение лицензирования;
2) представлять достоверные сведения в документах, подаваемых в лицензионную комиссию;
3) уплачивать сбор за выдачу лицензии;
4) обеспечить представительство аптечного учреждения на заседании лицензионной комиссии.
Данная статья определяет, что обязательными условиями для принятия решения о выдаче лицензии являются представление соискателем лицензии документов, подтверждающих право соискателя лицензии на использование помещений в целях осуществления фармацевтической деятельности, наличие сертификатов у специалистов, осуществляющих фармацевтическую деятельность.

Также необходимо санитарно-эпидемиологическое заключение о соответствии помещения требованиям санитарных правил. Это положение регулируется статьей 40 Федерального закона от 30 марта 1999 г. N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (с изм. от 9 мая 2005 г.).
Для получения указанных заключений соискатель лицензии представляет в федеральный орган контроля качества лекарственных средств следующие документы:
1) описание основных технологических процессов, обеспечивающих качество лекарственных средств;
2) согласие органов местного самоуправления на размещение производства лекарственных средств на данной территории;
3) заверенные в установленном порядке копии патентов РФ или разрешающих производство и продажу патентованных лекарственных средств лицензионных договоров.
Глава IX. РАЗРАБОТКА, ДОКЛИНИЧЕСКИЕ И КЛИНИЧЕСКИЕ
ИССЛЕДОВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Лицензирование фармацевтической деятельности
«О внесении изменений в некоторые акты Правительства Российской Федерации по вопросам обращения лекарственных средств для медицинского применения»
«О лицензировании фармацевтической деятельности»
«О совершенствовании государственного регулирования цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов»
ОБ УТВЕРЖДЕНИИ АДМИНИСТРАТИВНОГО РЕГЛАМЕНТА ПО ПРЕДОСТАВЛЕНИЮ ОРГАНАМИ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ СУБЪЕКТОВ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСУДАРСТВЕННОЙ УСЛУГИ ПО ЛИЦЕНЗИРОВАНИЮ ДЕЯТЕЛЬНОСТИ ПО ОБОРОТУ НАРКОТИЧЕСКИХ СРЕДСТВ И ПСИХОТРОПНЫХ ВЕЩЕСТВ (ЗА ИСКЛЮЧЕНИЕМ ДЕЯТЕЛЬНОСТИ, ОСУЩЕСТВЛЯЕМОЙ ОРГАНИЗАЦИЯМИ ОПТОВОЙ ТОРГОВЛИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И АПТЕЧНЫМИ ОРГАНИЗАЦИЯМИ, ПОДВЕДОМСТВЕННЫМИ ФЕДЕРАЛЬНЫМ ОРГАНАМ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ)
ПРИКАЗ от 7 июля 2015 г. N 419н
N 419н
«ОБ УТВЕРЖДЕНИИ АДМИНИСТРАТИВНОГО РЕГЛАМЕНТА ПО ПРЕДОСТАВЛЕНИЮ ОРГАНАМИ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ СУБЪЕКТОВ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСУДАРСТВЕННОЙ УСЛУГИ ПО ЛИЦЕНЗИРОВАНИЮ ФАРМАЦЕВТИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ (ЗА ИСКЛЮЧЕНИЕМ ДЕЯТЕЛЬНОСТИ, ОСУЩЕСТВЛЯЕМОЙ ОРГАНИЗАЦИЯМИ ОПТОВОЙ ТОРГОВЛИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ И АПТЕЧНЫМИ ОРГАНИЗАЦИЯМИ, ПОДВЕДОМСТВЕННЫМИ ФЕДЕРАЛЬНЫМ ОРГАНАМ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ, ГОСУДАРСТВЕННЫМ АКАДЕМИЯМ НАУК)»
ПРИКАЗ от 24 июля 2015 г. N 484н
«Об утверждении специальных требований к условиям хранения наркотических средств и психотропных веществ, зарегистрированных в установленном порядке в качестве лекарственных средств, предназначенных для медицинского применения в аптечных, медицинских, научно-исследовательских, образовательных организациях и организациях оптовой торговли лекарственными средствами»
Приказ Минздрава РФ №277 от 27. 05.2009г.
05.2009г.
«Об организации и осуществлении мониторинга ассортимента и цен на жизненно необходимые и важнейшие лекарственные препараты»
Приказ Минздрава РФн №735 от 26.08.2010г.
«Об утверждении Правил отпуска лекарственных препаратов для медицинского применения медицинскими организациями, имеющими лицензию на фармацевтическую деятельность, и их обособленными подразделениями (амбулаториями, фельдшерскими и фельдшерско-акушерскими пунктами, центрами (отделениями) общей врачебной (семейной) практики), расположенными в сельских поселениях, в которых отсутствуют аптечные организации»
Приказ Минздрава РФ №309 от 21.10.1997г.
«Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)»
Приказ Минздрава РФ №785 от 14.09.2005г.
«О Порядке отпуска лекарственных средств»
Приказ Минздрава РФ № 375 от 13.11.1996
«Об утверждении предельных норм естественной убыли (производственной траты) лекарственных средств на аптечных складах (базах)»
«Об установлении соответствия специальностей медицинских работников и фармацевтических работников, по которым до 18 марта 2014 года были выданы сертификат специалиста и (или) документ, подтверждающий присвоение квалификационной категории, специальностям, указанным в номенклатурах специальностей специалистов, имеющих медицинское и фармацевтическое образование, утвержденных в соответствии с частью 2 статьи 14 Федерального закона от 21 ноября 2011 г. N 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»
N 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»
«Об установлении соответствия должностей медицинских работников и фармацевтических работников, установленных до 18 марта 2014 года, должностям, указанным в номенклатурах должностей медицинских работников и фармацевтических работников, утвержденных в соответствии с частью 2 статьи 14 Федерального закона от 21 ноября 2011 г. N 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»
Приказы Минздрава КБР
Лицензирование фармацевтической деятельности: процедура, порядок, документы
Большинство обычных людей даже не подозревают, что для открытия простой аптеки нужно получить особое разрешение. Просто так торговать лекарствами нельзя, даже если их будет продавать сотрудник с медицинским образованием. Помимо аптек есть и много других видов деятельности в области фармацевтики, требующих получения лицензии. Данная статья расскажет вам о таком понятии как подлежащие лицензированию виды фармацевтической деятельности.
Помимо аптек есть и много других видов деятельности в области фармацевтики, требующих получения лицензии. Данная статья расскажет вам о таком понятии как подлежащие лицензированию виды фармацевтической деятельности.
Фармацевтическая деятельность и потребность в лицензировании
Кратко всю фармдеятельность можно уместить в нескольких словах. Такая деятельность подразумевает любые манипуляции с медикаментами. Чтобы производить, реализовывать, хранить и даже перевозить лекарственные препараты нужно получить лицензию.
Без получения соответствующего разрешения на работу с медицинскими средствами фармацевтическая деятельность незаконна. Наказание за это не только административная ответственность и большие штрафы.
Отсутствие лицензии может грозить реальным тюремным сроком, поэтому все стремятся своевременно получать этот документ, несмотря на некие сложности процесса.
Лицензия на осуществление фармацевтической деятельности
Функции
Давайте для начала узнаем, для кого предусмотрено лицензирование фармацевтической деятельности, каковы правовые основы и его функции.
Сама по себе лицензия — это просто бумажка, указывающая на легальность работы с лекарственными средствами. В ней указаны все виды деятельности, запрашиваемые конкретной компанией, подтвердивший соответствие условий.
Если лицензия разрешает розничную торговлю медикаментами, то это совсем не обозначает, что организация вправе заниматься оптовыми поставками.
Получение лицензии выполняет несколько функций:
- Уменьшается объем фальсифицированных лекарственных препаратов
- Снижается риски нарушений перевозки и условий хранения медикаментов
- Государство способно знать точный список фармацевтический организаций для контроля.
Такие меры обязательны для предоставления медицинским учреждениям и конечным потребителям максимально возможного уровня качества лекарственных средств. Процедура получения лицензии подразумевает определение условий для ведения такой деятельности и регулируется определенными документами и законами.
Про законы, положения и иные нормативные документы для регулирования вопроса о лицензировании фармацевтической деятельности рассмотрены ниже.
Нормативное регулирование
Получение разрешение на фармдеятельность согласно ФЗ о лицензировании фармацевтической деятельности №61-ФЗ от 12.04.10 в ст.52 ч. 1 допустимо не только для юридических лиц, но и для индивидуальных предпринимателей. Также при получении лицензии необходимо руководствоваться постановлением Правительства (ПП 1181) РФ «О лицензировании фармацевтической деятельности».
Этот документ был утвержден 22.12.2011 и отредактирован 23.09.2016. Также на законодательном уровне определены списки документов, необходимых для разных видов деятельности. С ними можно ознакомиться в постановлениях Правительства РФ №882 от 04.09.12, №342 от 15.04.13, №956 от 23.09.16.
Про сроки и управление лицензированием медицинской и медико-фармацевтических видов деятельности поговорим ниже.
Особенности получения лицензии
Выдача разрешения на фармацевтическую деятельность возможна только при соблюдении всех необходимых условий.
- За получением лицензии следует обращаться в Федеральную службу по надзору в сфере здравоохранения.

- В редких случаях переоформления разрешения, выдачей лицензии занимаются органы исполнительной власти конкретного муниципального образования.
Сам процесс получения разрешения не очень сложный. Основные трудности вызывают обязательность соблюдения всех необходимых условий и правильный сбор требуемого пакета документов.
Про основные принципы и условия лицензирования фармацевтической деятельности читайте ниже.
Список необходимых условий
Для предоставления лицензии необходимо соблюсти ряд требований. Даже руководитель организации должен обладать фармацевтическим образованием. Это же касается и индивидуальных предпринимателей. Для ведения работы в ветеринарными средствами также необходимо соответствующие образование.
Помимо этого необходимо соблюсти следующие условия:
- Иметь помещение в аренде или собственности
- При перевозках лекарств иметь собственных автопарк
- Заключить трудовые договора с сотрудниками, имеющими необходимое образование и стаж
- Помещения или транспортные средства должны быть оборудованы в соответствии с условиями хранения препаратов.

Если за лицензией на ведение фармацевтической деятельности обращается медучреждение или организация, то они уже должны иметь 1 разрешение. Речь идет о лицензии на медицинскую деятельность, сама по себе она не дает права транспортировать или реализовывать лекарственные препараты.
Лицензирование фармацевтической деятельности проводят при наличии определенных документов и сведений, о чем мы и поговорим ниже.
Форма заявления и требуемые документы
Для подачи заявления необходимо его правильная форма заполнения. Образец представлен в реестре лицензий на осуществление фармдеятельности. Неправильно заполненное заявление является поводом для возврата соискателю всего пакета документов.
К заявлению прикладываются такие данные:
- Квиток об оплате госпошлины.
- Заключение СЭС о пригодности помещения.
- Заверенные копии учредительных документов.
- Документы, подтверждающие квалификацию и стаж руководителя.
- Копии договоров аренды или свидетельств о собственности на помещение.

- Копии сертификатов, дипломов и свидетельств об образовании сотрудников.
- Трудовые договора с сотрудниками, имеющими соответствующее образование.
Если соискателем лицензии является медицинская организация, то к пакету документов добавляется копия их разрешения на работу. Все эти документы нужны как при первичном получении лицензии, так и при ее переоформлении.
Далее рассмотрен порядок лицензирования фармацевтической деятельности и субъект, который осуществляет его.
В этом видео дана инструкция по лицензированию фармацевтической деятельности:
Этапы оформления
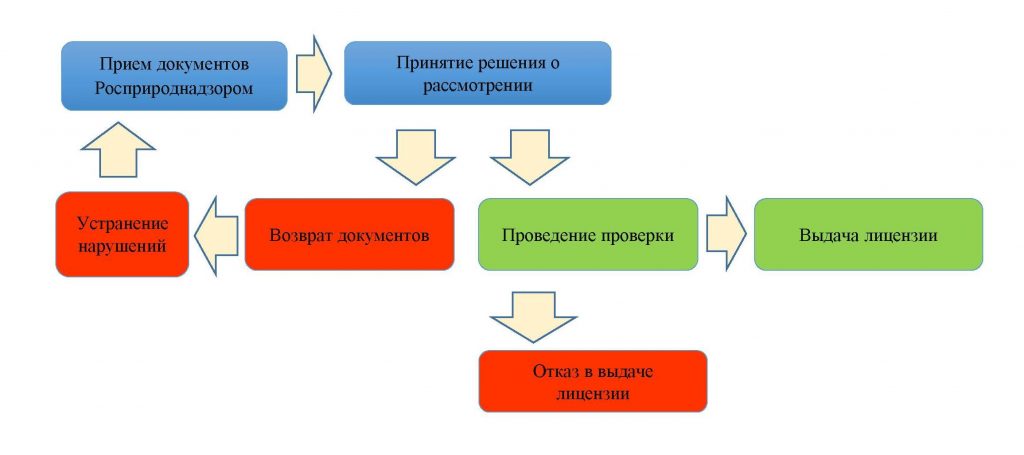
Процесс выдачи лицензии довольно длительный, уже после подачи заявления требуется 45 дней на рассмотрение. До этого момента необходимо еще предварительно проверить соответствие условиям и собрать требуемые документы. Детально получение лицензии выглядит так:
- Изучение условий и их корректировка
- Обращение в СЭС за справкой
- Сбор пакета документов и оплата госпошлины
- Заполнение заявления и его подача.

После этого соответствующие органы проводят экспертную проверку документов. При их правильном сборе, заявление считается принятым в рассмотрение. Далее проводится анализ соответствия помещения или транспорта необходимым условиям и после этого выдается лицензия.
При наличии неправильных документов или частичном несоответствии какому-либо условию, госорганы отказывают в получении разрешения, но выдают список предписаний, подлежащих исправлению. После выполнения необходимых указаний соискатель вправе обратиться за получением лицензии повторно.
Полезная информация
Согласно законодательству, лицензия на ведение фармацевтической деятельности выдается бессрочно. В то же время существует ряд причин, требующий повторно получить разрешение. Среди них есть очень незначительные изменения, но именно они и вынуждают вновь обращаться за выдачей лицензии.
Причины переоформления:
Получение и своевременно переоформление лицензии на фармацевтическую деятельность крайне важно. Эта не самая простая процедура, но она обязательна. При получении разрешения необходимо правильно собрать документы и соблюсти все условия предоставления лицензии, опираясь на нормативно-правовую базу.
Эта не самая простая процедура, но она обязательна. При получении разрешения необходимо правильно собрать документы и соблюсти все условия предоставления лицензии, опираясь на нормативно-правовую базу.
Данное видео рассказывает про новое в лицензировании фармацевтической деятельности:
Лицензирование фармацевтической деятельности — ДЗМ
Уважаемые соискатели лицензии и лицензиаты!
Департамент здравоохранения города Москвы просит Вас при представлении заявления о предоставлении и переоформлении лицензий и прилагаемых к ним документов на бумажном носителе размещать указанные документы в папки (скоросшиватели, короны).
Справочная информация
Управление лицензирования и аккредитации Департамента здравоохранения города Москвы:
тел.: +7 (495) 652-82-46; факс: +7 (495) 962-13-33.
Прием заявлений и документов на предоставление, переоформление лицензии на фармацевтическую деятельность осуществляется Управлением лицензирования и аккредитации Департамента здравоохранения города Москвы по адресу:
г. Москва, площадь Журавлева, д. 12.
вторник и четверг
с 09.00 до 12.00 и с 14.00 до 16.00
Тел.: +7 (495) 652-82-47
Выдача лицензий, дубликатов лицензий, копий лицензий, уведомлений о прекращении деятельности, выписок из реестра лицензий либо копий актов о принятом решении, справок об отсутствии запрашиваемых сведений в реестре лицензий, решений об отказе в предоставлении государственной услуги в Управлении лицензирования и аккредитации Департамента здравоохранения города Москвы (в случае указания в запросе получения результата предоставления государственной услуги на бумажном носителе лично):
понедельник — четверг
с 09.00 до 12.00 и с 14.00 до 16.00
Тел.: +7 7 (495) 652-82-47
Прием заявлений на предоставление дубликата лицензии, копии лицензий, заявлений о прекращении деятельности, запросов о предоставлении сведений о конкретной лицензии на фармацевтическую деятельность осуществляется Департаментом здравоохранения города Москвы по адресу:
г. Москва, Оружейный пер., д. 43
(понедельник-четверг c 8.00 до 12.30 и с 13.15 до 17.00;
пятница c 8.00 до 12.30 и с 13.15 до 16.45).
Информация о ходе принятия решений по обращениям соискателей лицензий, лицензиатов о предоставлении лицензии, переоформлении лицензии
Подтверждение лицензиатами соблюдения лицензионных требований при осуществлении фармацевтической деятельности
Лицензирование фармацевтической деятельности и видов деятельности, связанных с оборотом наркотических средств, психотропных веществ и их прекурсоров
Авторы: Кононова С. В., Чеснокова Н. Н., Баранов Д. Е., Аношкина Е. В.Введение.
Фармацевтическая деятельность в большинстве стран относится к наиболее регулируемым государством видам деятельности. Государственные органы власти активно воздействуют на фармацевтический рынок через целевые закупки продукции, оплату работ и услуг из средств бюджетов различных уровней, установление ограничений списков лекарственных средств для определенных категорий населения, прямое или косвенное влияние цены, а также регулируют деятельность через механизм лицензирования. Система лицензирования дает единственно эффективную возможность воздействия на фармацевтическую организацию (ФО). Деятельность органов лицензирования оказывает не только стимулирующее и дисциплинирующее влияние на работу лицензиатов, но и нацеливает их на постоянное повышение уровня профессиональной деятельности как государственных, так и частных ФО.
Следует отметить, что в рыночных условиях фармацевтическая деятельность усложняется. Это связано с финансово-хозяйственной деятельностью как отдельных аптечных организаций, так и аптечных сетей, наличием различных форм собственности – государственной, муниципальной, частной. В связи с этим потребность государственного регулирования видов деятельности в сфере обращения лекарственных средств не только не снижается, но и значительно возрастает. Это обусловлено изменением всей правовой базы деятельности субъектов лекарственного бизнеса и гармонизацией ее с международными нормами регулирования деятельности на фармацевтическом рынке.
Практика деятельности лицензирующих органов показала, что функционирует достаточно стройная, жизнеспособная государственная система, которая обеспечивает в пределах своей компетенции выполнение конституционных прав граждан на получение качественной, безопасной лекарственной помощи в необходимом объеме.
Вопросы, затрагиваемые в пособии, направлены на приобретение знаний в области основ процесса лицензирования фармацевтической деятельности, а также деятельности по обороту наркотических средств и психотропных веществ. Изучение этих вопросов позволит решать задачи по оказанию квалифицированной современной качественной фармацевтической помощи, даст основу для успешного управления фармацевтической организацией.
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА ЛИЦЕНЗИРОВАНИЯ
1.1. Нормативно-правовая база лицензирования фармацевтической деятельности
Основные нормативно-правовые документы, регламентирующие процедуры госконтроля и надзора.
1. ФЗ от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности»
2. ФЗ от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»
3. ФЗ от 08.01.1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах»
4. ФЗ от 26.12.2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
5. Постановление Правительства РФ от 21.11.2011 № 957 «Об организации лицензирования отдельных видов деятельности»
6. Постановление Правительства РФ от 30.03.1998 г. № 681 «Об утверждении перечня наркотических средств и их прекурсоров, подлежащих контролю в Российской Федерации»
7. Постановление Правительства РФ от 22.12.2011 г. № 1081 «О лицензировании фармацевтической деятельности»
8. Постановление Правительства РФ от 30.06.2004 г. № 323 «об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения»
9. Постановление Правительства РФ от 22.12.2011 г. № 1085 «О лицензировании деятельности по обороту наркотических средств, психотропных веществ и их прекурсров, культивированию наркосодержащих растений»
10. Постановление Правительства РФ от 12.06.2008 г. № 449 «О порядке перевозки НС, ПВ и их прекурсоров на территории РФ, а также оформления необходимых для этого документов»
11. Постановление Правительства РФ от 16.04.2012 г. № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)»
12. Постановление Правительства РФ от 09.06.2010 № 419 «О предоставлении сведений о деятельности, связанной с оборотом прекурсоров НС и ПВ, и регистрации операций, связанных с их оборотом»
13. Постановление Правительства РФ от 03.09.2010 г. № 674 «Об утверждении Правил уничтожения лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств»
14. Постановление Правительства РФ от 18.08.2010 г. № 640 «Об утверждении правил производства, переработки, хранения, реализации, приобретения, использования, перевозки и уничтожения прекурсоров НС и ПВ»
15. Постановление Правительства РФ от 06.08.1998 г. № 892 «Об утверждении Правил допуска лиц к работе с НС и ПВ, а также к деятельности, связанной с оборотом прекурсоров НС и ПВ»
16. Постановление Правительства РФ от 20.07.2011 г. № 599 «О мерах контроля в отношении препаратов, которые содержат малые количества НС, ПВ и их прекурсоров, включенных в перечень НС, ПВ и их прекурсоров, подлежащих контролю в РФ.
17. Указ Губернатора Нижегородской области от 27.03.2012 № 19 «Об утверждении административных регламентов предоставления министерством здравоохранения Нижегородской области государственных услуг по лицензированию отдельных видов деятельности»
18. Приказ МЗ РФ от 13.12.2012 г. № 1040н «Об утверждении Положения о территориальном органе Федеральной службы по надзору в сфере здравоохранения»
19. Приказ МЗ РФ от 25.03.2014 г. № 130н «Об утверждении административного регламента Федеральной службы по надзору в сфере здравоохранения по представлению государственной услуги по лицензированию фармацевтической деятельности, осуществляемой организациями оптовой торговли лекарственными средствами для медицинского применения и аптечными организациями, подведомственными федеральным органам исполнительной власти, государственным академиям наук»
20. Приказ Министерства здравоохранения и социального развития России от 16.03.2010 г. № 157н «Об утверждении предельно допустимого количества НС, ПВ и их прекурсора, содержащегося в препаратах»
21. Приказ Росздравнадзора от 15.02.2012 г. № 547-Пр/12 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования фармацевтической деятельности»
22. Приказ Росздравнадзора от 28.11.2006 г. № 2549-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования деятельности, связанной с оборотом наркотических средств и психотропных веществ, внесенных в Список II»
23. Приказ Министерства здравоохранения и социального развития и Федеральной службы по надзору в сфере здравоохранения и социального развития от 09.10.2006 г. № 2284-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования фармацевтической деятельности»
24. Письмо Росздравнадзора от 26 октября 2011 г. № 04И-1000/11 «О лицензировании»
25. Письмо Министерства здравоохранения и социального развития РФ от 3 февраля 2012 г. № 25-1/10/2-855
26. Письмо Министерства здравоохранения и социального развития РФ от 06.06.2012 г. № 975/25-1 «О порядке отпуска кодеинсодержащих лекарственных препаратов»
27. Письмо Министерства здравоохранения РФ от 13.0.2014 № 25-4/10/2-79
28. Письмо Министерства здравоохранения и социального развития РФ № 25-1/10/2-1208 от 8 февраля 2011 г. (разъяснение о хранении ЛС).
1.2. Основные понятия, принципы процесса лицензирования
Федеральный закон от 4 мая 2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» устанавливает правовые основы государственной политики и регулирует отношения, возникающие между федеральными органами исполнительной власти, органами исполнительной власти субъектов Российской Федерации, юридическими лицами и индивидуальными предпринимателями в связи с осуществлением лицензирования отдельных видов деятельности.
Основные понятия
Статья 3 Федерального закона от 04.05.2014 № 99-ФЗ дает определение следующим понятиям:
лицензирование – деятельность лицензирующих органов по предоставлению, переоформлению лицензий, продлению срока действия лицензий в случае, если ограничение срока действия лицензий предусмотрено федеральными законами, осуществлению лицензионного контроля, приостановлению, возобновлению, прекращению действия и аннулированию лицензий, формированию и ведению реестра лицензий, формированию государственного информационного ресурса, а также по предоставлению в установленном порядке информации по вопросам лицензирования;
лицензия – специальное разрешение на право осуществления юридическим лицом или индивидуальным предпринимателем конкретного вида деятельности (выполнения работ, оказания услуг, составляющих лицензируемый вид деятельности), которое подтверждается документом, выданным лицензирующим органом на бумажном носителе или в форме электронного документа, подписанного электронной подписью, в случае, если в заявлении о предоставлении лицензии указывалось на необходимость выдачи такого документа в форме электронного документа;
лицензируемый вид деятельности – вид деятельности, на осуществление которого на территории Российской Федерации и на иных территориях, над которыми Российская Федерация осуществляет юрисдикцию в соответствии с законодательством Российской Федерации и нормами международного права, требуется получение лицензии;
лицензирующие органы – уполномоченные федеральные органы исполнительной власти и (или) их территориальные органы, а в случае передачи осуществления полномочий Российской Федерации в области лицензирования органам государственной власти субъектов Российской Федерации органы исполнительной власти субъектов Российской Федерации, осуществляющие лицензирование;
соискатель лицензии – юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий орган с заявлением о предоставлении лицензии;
лицензиат – юридическое лицо или индивидуальный предприниматель, имеющие лицензию;
лицензионные требования – совокупность требований, которые установлены положениями о лицензировании конкретных видов деятельности, основаны на соответствующих требованиях законодательства Российской Федерации и направлены на обеспечение достижения целей лицензирования;
место осуществления отдельного вида деятельности, подлежащего лицензированию (место осуществления лицензируемого вида деятельности), — объект (помещение, здание, сооружение, иной объект), который предназначен для осуществления лицензируемого вида деятельности и (или) используется при его осуществлении, соответствует лицензионным требованиям, принадлежит соискателю лицензии или лицензиату на праве собственности либо ином законном основании, имеет почтовый адрес или другие позволяющие идентифицировать объект данные. Место осуществления лицензируемого вида деятельности может совпадать с местом нахождения соискателя лицензии или лицензиата.
Основные принципы осуществления лицензирования
Согласно статье 4 Федерального закона от 04.05.2014 № 99-ФЗ основными принципами осуществления лицензирования являются:
1) обеспечение единства экономического пространства на территории Российской Федерации;
2) установление лицензируемых видов деятельности федеральным законом;
3) установление федеральными законами единого порядка лицензирования отдельных видов деятельности на территории Российской Федерации;
4) установление исчерпывающих перечней лицензионных требований в отношении лицензируемых видов деятельности положениями о лицензировании конкретных видов деятельности;
5) открытость и доступность информации о лицензировании, за исключением информации, распространение которой запрещено или ограничено в соответствии с законодательством Российской Федерации;
6) недопустимость взимания с соискателей лицензий и лицензиатов платы за осуществление лицензирования, за исключением уплаты государственной пошлины в размерах и в порядке, которые установлены законодательством Российской Федерации о налогах и сборах;
7) соблюдение законности при осуществлении лицензирования.
Чтобы читать дальше, купите книгу.
Стоимость:
Требования к лицензированию и обслуживанию аптек
Узнайте о национальных требованиях к лицензированию аптек.
Обзор требований к лицензированию аптек
Как и большинство медицинских учреждений, аптеки строго регулируются и должны получить ряд государственные и федеральные лицензии. Хотя лицензионные и регистрационные требования — это только часть нормативных проблем, с которыми сталкиваются аптеки, соблюдение этих требований является ключом к получение и поддержание законных полномочий на управление аптекой.
Для новых аптек требования к регистрации обычно начинаются с создания юридического лица. Создание нового юридического лица обычно состоит из регистрации бизнеса у секретаря укажите в выбранном вами штате, получив идентификационный номер работодателя (EIN) от IRS, и регистрация на налоговой отчетности предприятий через налоговый отдел.
После образования юридического лица аптеки могут начать процесс подачи заявки на получение лицензии на деятельность и разрешения, как правило, через государственную аптечную комиссию.На этом этапе процесса лицензирования аптеки должны знать, какие списки контролируемых веществ они планируют распространять, тип услуг, которые будут предложены, местонахождение объекта, и кто будет действовать в качестве фармацевт, ответственный за учреждение.
Требования к разрешению аптеки различаются в зависимости от штата, но многие заявки на разрешение требуют:
- Информация о хозяйствующем субъекте
- Тип аптеки (розничная, больничная, стерильная, ядерная и т. Д.).)
- Информация об ответственном фармацевте, включая номер лицензии
- Учредительный договор
- Список должностных лиц и владельцев бизнеса
- Дисциплинарное и уголовное дело владельцев и сотрудников аптеки
- Список другого лицензированного персонала, который будет управлять аптекой, например техников аптеки. и фармацевты-стажеры
- Режим работы аптеки
- Сборы за подачу заявки и лицензионные сборы
После подачи и утверждения заявки на разрешение штаты обычно требуют, чтобы объект пройти проверку на соответствие различным правилам аптек.Пройдя осмотр, будет выдано разрешение на аптеку.
В дополнение к разрешению на работу аптеки, которые распространяют контролируемые вещества, вероятно, будут необходимо получить регистрацию контролируемого вещества. Эти регистрации обычно администрируются Государственный совет по аптекам и часто может быть подан одновременно с разрешением на аптеку Приложения.
В зависимости от услуг, которые они предлагают, некоторым аптекам также может потребоваться подать заявку на дополнительное государственное обслуживание. лицензии.Например, от аптек, распространяющих медицинские устройства, может потребоваться получение лицензия продавца медицинского оборудования.
После лицензирования аптек на уровне штата большинство аптек должны пройти федеральную регистрацию. требования. Как правило, аптеки обязаны получить национальный идентификатор поставщика медицинских услуг (NPI). количество как часть соответствия стандартам HIPAA, и аптеки, которые распространяют контролируемые вещества должен подать заявку на регистрацию в Федеральном законе о контролируемых веществах в Управлении по борьбе с наркотиками. Администрация (DEA).
Разрешения и регистрации аптек обычно выдаются для каждого местоположения, поэтому, если вы работаете несколько аптек, вам нужно будет подать уникальные заявки для каждого объекта место расположения.
Лицензия нескольких штатов
Аптеки, работающие в нескольких штатах, столкнутся с дополнительными лицензионными требованиями в каждое государство, которое они обслуживают.Даже объекты без физического присутствия в состоянии, такие как почта заказ или интернет-аптеки, могут оказаться предметом лицензионных требований, когда они дозировать контролируемые вещества в новом состоянии.
Прежде чем обращаться в аптеку с просьбой о выдаче лицензий или разрешений, аптекам может потребоваться иностранцы квалифицируют свое коммерческое предприятие с государственным секретарем в зависимости от их бизнеса деятельность в гос.
При подаче заявления на получение разрешения на аптеку для нерезидентов штаты обычно требуют, чтобы заявители указали ответственный фармацевт, имеющий активную лицензию в этом штате. Государства также могут потребовать нерезидентов аптеки должны подавать подтверждения лицензии и отчета о проверке через Проверенную аптеку Программа (VPP).
В дополнение к лицензионным требованиям, аптеки, расширяющие свои услуги на другие штаты, могут нести налоговые обязательства в этих штатах.Государственные налоговые департаменты обычно требуют регистрации юридических лиц. для корпоративного подоходного налога, а также для организаций с наемными работниками в штате, удержания и безработицы страховые налоги.
Аптеки, расположенные в нескольких штатах, также должны убедиться, что они зарегистрированы в качестве поставщика услуг Medicaid. при предоставлении услуг клиентам, охваченным Medicaid. Регистрация поставщиков Medicaid проводится по адресу: на уровне штата, поэтому аптеки должны подавать отдельные заявки на регистрацию для каждого штата.
Соблюдение нормативных требований
После получения лицензий аптеки должны обратить свое внимание на сохранение своих лицензий и разрешения. Лицензии, которые не обслуживаются должным образом, могут быстро перейти в неактивный статус и могут полностью аннулируются, если им пренебрегают.
Разрешения на работу аптек обычно истекают ежегодно или раз в два года, хотя в некоторых штатах их продлевают раз в три года. периоды.Чтобы поддерживать хорошую репутацию аптеки, необходимо подать заявление на продление и уплатить пошлину. быть подано до даты продления разрешения. Компании, которые управляют несколькими объектами, будут иметь более одного разрешения на продление, поэтому важно внимательно отслеживать, когда необходимо подавать заявление на продление расположение каждой аптеки.
Аптеки также должны регулярно продлевать регистрацию контролируемых веществ. Большинство государственных регистрация продлевается ежегодно, в то время как регистрация в соответствии с федеральным законом о контролируемых веществах продлевается каждые три года. для аптек.
Для аптек, находящихся в нескольких штатах, процесс продления становится еще более сложным. В во многих случаях организации с несколькими штатами должны не отставать от продления разрешений на аптеки, контролируемых веществ продление регистрации и требования к годовому отчету государственного секретаря в каждом штате, где объект расположен.
В дополнение к этим структурированным мероприятиям по продлению аптеки также должны уведомить правление о Информация о ответственном фармацевте, владельце, местонахождении и других объектах меняется по мере их появления.Многие государственные комитеты также требуют, чтобы ответственный фармацевт заполнял годовой отчет о самопроверке убедиться, что аптека соответствует нормативным требованиям. В большинстве случаев в этих отчетах нет необходимости должны быть представлены на доске, но должны быть доступны и предоставлены по запросу.
Соблюдение требований каждого штата, отслеживание продлений и своевременная подача заявок имеют решающее значение для избежания штрафов.Выделенное соответствие услуги и программное обеспечение могут помочь вам отслеживать различные требования юрисдикции и соответствующие обновления законов штата.
Изучите лицензирование по штатам
Щелкните ссылку ниже, чтобы просмотреть информацию о лицензировании в вашем штате.
Ключевые термины
Регистрация контролируемых веществ — Помимо лицензии на аптеку, регистрация контролируемых веществ требуется во многих штатах для аптек, которые распространяют контролируемые вещества.
NABP (Национальная ассоциация фармацевтических советов) — принимает различные программы и ресурсы, связанные с лицензированием и проверкой фармацевтов и аптек.
Ответственный фармацевт — лицензированный фармацевт, назначенный аптекой в качестве стороны, ответственной за соблюдение нормативных требований.
VPP (Программа проверенных аптек) — Программа, выполняемая NABP, которая позволяет советам штатов обмениваться информацией и упростить регистрацию аптек за пределами штата.
Что такое входящее лицензирование? | Что следует знать инвесторам
В настоящее время лицензирование может быть предпочтительным способом развития бизнеса фармацевтических компаний. Должно ли это повлиять на вашу инвестиционную стратегию?
Когда дело доходит до инвестирования в фармацевтические компании, важно смотреть на трубопроводы, а также на перспективы исследований и разработок.Но получение лицензии также является ключевым моментом при рассмотрении этих акций.
Фактически, в наши дни сделки по лицензированию могут быть предпочтительным способом развития бизнеса фармацевтической отрасли — возможно, даже в большей степени, чем слияния и поглощения (M&A). Эти соглашения могут оказаться очень плодотворными для компаний и цен на их акции.
Стратегия внутреннего лицензирования также привлекательна для инвесторов: добавление лицензий на лекарства ускоряет корпоративное развитие, а также снижает риски.Итак, давайте проясним некоторые общие вопросы, связанные со стратегией.
В статье ниже рассказывается о том, что означает получение лицензии на лекарство и чем ее отличается от приобретения. Здесь также рассматривается, как роялти влияют на доходность. Инвесторам важно знать об этих тонкостях, чтобы они могли правильно интерпретировать действия фирмы и сделать выбор в пользу покупки или продажи в нужное время.
Объяснение лицензирования
Некоторые вещи лучше всего объяснить на примере, поэтому давайте взглянем на AMAG Pharmaceuticals (NASDAQ: AMAG).В середине 2020 года фармацевтическая компания выдала лицензию на использование антикоагулянтного реверсивного агента на клинической стадии для Norgine, ведущей европейской специализированной фармацевтической компании.
Согласно лицензионному соглашению, две компании возьмут на себя разработку и коммерциализацию ciraparantag в Европе, Австралии и Новой Зеландии. Препарат-кандидат предназначен для отмены антикоагулянтного эффекта прямых пероральных антикоагулянтов и низкомолекулярного гепарина у пациентов, которые используют эти продукты и нуждаются в экстренной операции или испытывают опасное для жизни неконтролируемое кровотечение.Цирапарамтаг восстанавливает способность организма образовывать тромбы.
Запланированные на Фазу 3 клинические испытания препарата приблизят его к разрешению регулирующих органов США, Великобритании и Европейского Союза.
В этом соглашении Norgine является внутренним лицензиаром, то есть лицензирует продукт от AMAG; AMAG, которая лицензирует свой продукт Norgine, является сторонним лицензиатом. Эти сделки популярны, поскольку они позволяют одной компании (в данном случае Norgine) взять на себя часть финансовых, нормативных или технологических затрат, связанных с разработкой продукта другой компании (в данном случае AMAG).Оба в конечном итоге получают выгоду.
AMAG получает авансовый платеж в размере 30 миллионов долларов США и будет иметь право на получение до 260 миллионов долларов США при достижении определенных нормативных показателей и показателей продаж, в дополнение к гонорарам и возможности расширения ассортимента продукции. Как сказал генеральный директор AMAG Скотт Майерс во время подписания соглашения: «Раскрытие ценности цирапарантага… еще больше укрепит способность нашей компании продолжать инвестировать в инновационные методы лечения, направленные на удовлетворение неотложных неудовлетворенных медицинских потребностей».
Между тем, в обмен на помощь в финансировании фазы 3 клинических испытаний цирапарантага, Norgine получит все разрешения на продажу этого препарата на лицензированных территориях.Norigine также будет нести ответственность за нормативные заявки и любые последующие испытания, необходимые для утверждения на ее территории.
Сотрудничество между AMAG и Norgine — лишь один из примеров in-лицензирования. Другие недавние примеры этой стратегии включают Biogen (NASDAQ: BIIB) и Sangamo Therapeutics (NASDAQ: SGMO), которые заключили глобальное лицензионное соглашение на разработку лекарственных препаратов для лечения неврологических заболеваний, включая болезни Альцгеймера и Паркинсона.
Есть также международный фармацевтический гигант Merck (NYSE: MRK) и корейская компания Hanmi Pharmaceutical (KRX: 008930).В середине 2020 года они подписали эксклюзивное лицензионное соглашение на эфинопегдутид, экспериментальный двойной агонист глюкагоноподобного пептида-1 / рецептора глюкагона, который используется Hanmi для лечения неалкогольного стеатогепатита.
По соглашению, Merck получает эксклюзивную лицензию на разработку, производство и коммерциализацию эфинопегдутида в Соединенных Штатах и во всем мире. Взамен Hanmi получит авансовый платеж в размере 10 миллионов долларов США и имеет право на получение промежуточных платежей в размере до 860 миллионов долларов США.
In-лицензирование становится все более и более обычным явлением, отчасти из-за притока на рынок небольших биотехнологических компаний. Эти компании на ранней стадии являются ключевым источником многообещающих кандидатов на продукты, на которые фармацевтические компании затем выдают лицензии на определенные права.
Преимущества встроенного лицензирования
In-лицензирование экономически выгодно, поскольку финансовое бремя разработки продукта разделяется. Это также снижает риск покупательной способности компании, поскольку она может заключать сделки на основе многообещающих доклинических или клинических результатов.Сравните это с традиционным процессом открытия лекарств, когда компания приступает к реализации проекта, вкладывая значительные средства в его разработку — и все это с небольшими данными, подтверждающими ожидания.
In-licensing также имеет большую привлекательность по сравнению с прямыми слияниями и поглощениями. Это потому, что лицензии позволяют фармацевтическим компаниям приобретать права на экспериментальные препараты, не беря на себя чужой багаж, включая нежелательные технологии.
Все это означает, что получение дополнительных лицензий может иметь большое значение как для фармацевтических компаний, так и для инвесторов.Но, как упоминалось выше, это также может вызвать путаницу — замешательство, которое может привести к принятию неверно информированных решений со стороны инвесторов.
Общие сведения о лицензировании
Так же, как фармацевтические компании всегда ищут следующий препарат-бестселлер, инвесторы ищут компанию, которая будет его разрабатывать. По этой причине лицензионные соглашения могут несколько отталкивать — даже если лекарство окажется чрезвычайно успешным, его прибыль необходимо будет разделить между двумя фармацевтическими компаниями и, следовательно, двумя группами акционеров.
Так было в случае с Eliquis, антикоагулянтом, совместно разработанным компаниями Pfizer (NYSE: PFE) и Bristol-Myers Squibb (NYSE: BMY). Открытие и клиническое продвижение были завершены последним, который объединил усилия с Pfizer только на поздних стадиях испытаний.
Это озадачило некоторых инвесторов — в конце концов, препарат казался потенциальным блокбастером. Это будет новинка на рынке, которая принесет пользу большому количеству пациентов. Зачем делить прибыль с другой компанией, а та опаздывает в игру?
Как поясняет Джон ЛаМаттина в Forbes, на момент заключения сделки еще было много вопросов об успехе Eliquis.Рынок антикоагулянтов является конкурентным, и не было никаких гарантий, что этот препарат окажется более эффективным, чем аналогичные продукты, также находящиеся в стадии разработки. Более того, испытания фазы 3 являются дорогостоящими, и Bristol-Myers Squibb столкнулась с ограниченным бюджетом на исследования и разработки.
В случае с Pfizer компания Bristol-Myers Squibb снизила риски и финансовые трудности, связанные с утверждением Eliquis. На внедрение препарата ушло много времени, но сегодня он приносит прибыль обеим фармацевтическим компаниям.
Соглашения о лицензировании также могут вызвать путаницу, усложняя финансовую отчетность. «Обычно они не регистрируются как активы в балансе», — пояснил Investing News Network Джефф Марголис, вице-президент RespireRx (OTCQB: RSPI).
«Они считаются« незавершенными исследованиями и разработками », а расходы считаются расходами в отчете о прибылях и убытках, что обычно приводит к большим убыткам».
Это означает, что непосвященный инвестор может неверно истолковать финансовый отчет компании, поскольку он «не учитывает стоимость лицензий».Как сказал Марголис, «актив нематериален».
Устойчивый, но не традиционный
По мере того, как производители фармацевтической продукции все больше склоняются к внутреннему лицензированию, они обычно сокращают свои огромные бюджеты на исследования и разработки. Это может смутить инвесторов, привыкших к традиционной модели роста фармацевтики: открытие новых лекарств ведет к продукции, которая ведет к прибыли.
Но помните, что открытие лекарств также ведет к большим потерям. Фармацевтические компании тратят миллионы на разработку, но только каждый десятый кандидат на продукт выходит на рынок.Дополнительное лицензирование может дать возможность сократить расходы и разделить бремя риска.
К тому же, поскольку фармацевтические инвесторы все больше осознают, что лекарств-блокбастеров в наши дни мало, и они далеки от них. «Индустрия стала жертвой собственных предыдущих успехов», — объясняет Дэн Херли в статье для New York Times. «Чтобы добиться успеха, он должен создавать лекарства, которые работают лучше, чем блокбастеры прошлого».
In-лицензирование может быть нетрадиционным, но это может быть более устойчивый метод фармацевтического роста.Поскольку крупные фармацевтические компании принимают эту модель, инвесторы также должны корректировать свое мышление. Старые правила могут больше не применяться, и важно пересмотреть инвестиционные стратегии в свете изменений в отрасли.
Теперь, когда вы знаете немного больше о лицензировании, повлияет ли это на ваши инвестиции в фармацевтические компании и почему? Дайте нам знать в комментариях ниже.
Это обновленная версия статьи, первоначально опубликованной Investing News Network в 2016 году.
Не забудьте подписаться на нас @INN_Resource, чтобы получать новости в реальном времени!
Раскрытие информации о ценных бумагах: Я, Мелисса Пистилли, не имею доли прямых инвестиций в какой-либо компании, упомянутой в этой статье.
АптекаNYS: Требования к лицензии
Общие требования | Сборы | Частичное Возврат | Образование Требования | Экзамен Требования | Опыт Требования | Претенденты Лицензия в другом государстве | Абитуриенты с иностранным образованием
Общие требования
Любое использование названия «фармацевт» в штате Нью-Йорк. требует лицензии.
Чтобы иметь лицензию фармацевта в штате Нью-Йорк, вы должны:
- иметь хорошие моральные качества;
- быть не моложе 21 года; и
- соответствует требованиям к образованию, экзаменам и опыту.
Конкретные требования к лицензированию содержатся в Разделе 8, статья 137, раздел 6805 Закона штата Нью-Йорк об образовании и Часть 63 Регламент Уполномоченного.
Вам также следует прочитать общие информация о лицензировании применима ко всем профессиям.
Комиссии
Плата за лицензирование составляет 339 долларов.
Плата за ограниченное (стажерское) разрешение составляет 70 долларов (ограниченный сбор за разрешение не возвращается).
Указанная комиссия — это комиссия, действовавшая на момент публикации этой страницы. Тарифы могут быть изменены. Плата взимается в соответствии с законом, когда ваша заявка получена (если комиссия не будет увеличена задним числом).Вам будет выставлен счет за разницу, если комиссия будет увеличена.
ПРИМЕЧАНИЕ: Платеж отправлен извне Соединенные Штаты должны быть внесены чеком или векселем на Соединенные Штаты. В банке США и в валюте США; платежи, представленные в любая другая форма не будет принята и будет возвращена.
Частичный возврат
Лица, отозвавшие заявку на лицензию, могут иметь право к частичному возмещению.
- Для процедуры отзыва заявки обращайтесь в Аптечный отдел [email protected] или по телефону 518-474-3817 доб. 250 или по факсу 518-402-5354.
- Государственный департамент образования не несет ответственности за какие-либо сборы выплачивается стороннему агентству по тестированию или проверке полномочий.
Если вы отзовете заявку, получите возмещение, а затем решите чтобы позднее получить лицензию штата Нью-Йорк, вы будете считаться новый заявитель, и вы должны будете оплатить лицензию и регистрационные сборы и соответствовать требованиям лицензирования на месте при повторной подаче заявки.
Требования к образованию
Для соответствия требованиям профессионального образования для получения лицензии как фармацевт вы должны иметь:
- окончил программу фармацевтики со степенью бакалавра.
или выше из аптечной программы, аккредитованной
Аккредитация
Совет по фармацевтическому образованию (ACPE)
.
Подтверждение образования
По окончании обучения вы должны запросить Форму 2 или официальную стенограмму. со степенью и датой присуждения высылать прямо в офис Профессий по адресу, указанному на форме.
OR,
- окончил аптечную программу, аккредитованную канадской
Совет по аккредитации аптечных программ (CCAPP):
- в период с 1993 по 2004 год (см. Раздел I, «Подтверждение «Образование» выше) или,
- до 1993 г. (см. Раздел III, «Доказательство образования»). ниже).
OR,
- завершила аптечную программу, не аккредитованную ACPE
или CCAPP, и:
- завершили программу фармацевтики со степенью,
диплом или аттестат по аптеке (на уровне бакалавра
степень или ее эквивалент) признаны соответствующими
гражданские органы юрисдикции, в которой школа
расположен как отвечающий требованиям образования для поступления
на практике в этой юрисдикции.
А,
- имеет экзаменационную комиссию иностранных аптек
(FPGEC) сертификация Национальной ассоциацией советов директоров
аптеки (НАБП).
Для получения информации о сертификации FPGEC, обращайтесь:
Национальная ассоциация фармацевтических советов (NABP)
1600 Feehanville Drive
Mt Prospect, IL 60056
Телефон: 847-391-4406
Интернет: www.набп. аптекаА,
- Департамент образования штата Нью-Йорк должен определить
что программа неаккредитованных аптек соответствует следующим
Требования к подготовительной и профессиональной подготовке:
- Preprofessional Study
Не менее 60 часов предпрофессионального обучения в семестр по фундаментальным наукам и общеобразовательному содержанию области, минимум 20 семестровых часов в область содержания фундаментальных наук и минимум 20 семестр часов в области содержания общего образования.
Область содержания фундаментальных наук включает, но не ограничивается к курсовой работе:
- математика;
- биологических наук, включая, но не ограничиваясь общей биологии; и
- физических наук, включая, но не ограничиваясь общей и органической химии.
Область содержания общего образования включает, но не ограничивается курсовой работой по каждой из следующих областей:
- социальные и поведенческие науки и
- гуманитарных наук, включая английский, но не ограничиваясь им.
- Профессиональное обучение
Не менее 90 семестровых часов профессионального обучения в биомедицинских науках, фармацевтических науках, и области содержания клинических наук, с минимумом 15 семестровых часов по содержанию биомедицинских наук область, минимум 20 семестровых часов в фармацевтике область содержания естественных наук, и минимум 15 семестр часов в области содержания клинических наук.
Область содержимого «Биомедицинские науки» включает, но является не ограничиваясь курсовыми работами по каждому из следующих площади:
- анатомия;
- физиология;
- микробиология / иммунология;
- биохимия;
- патология; и
- биостатистика.
Область содержания фармацевтических наук включает, но не ограничивается курсовой работой по каждому из следующих площади:
- фармацевтическая или медицинская химия;
- основная фармацевтика, включая, но не ограничиваясь рецептуре и дозированию;
- биофармацевтика;
- фармакокинетика;
- фармакогнозия или натуральные продукты;
- фармакология; и
- администрация аптеки.
Область содержания «Клинические науки» означает курсовую работу в клинических приложений с использованием знаний, полученных в содержание биомедицинских и фармацевтических наук области, включая, но не ограничиваясь, курсовую работу в каждое из следующих:
- клинико-практические фонды;
- болезненных процессов;
- клиническая фармакология и терапия; и
- информация о лекарствах и оценка литературы.
Дополнительно курсовая работа по клиническим наукам область содержания должна включать соответствующее сочетание клинических опыт работы в общественных и институциональных аптеках и в соответствующих стационарных и амбулаторных условиях.
- Preprofessional Study
Подтверждение образования
Отправьте форму 2 в вашу школу и попросите их заполнить и вернуть его с официальной расшифровкой прямо в Офис Профессии по адресу, указанному в анкете. - завершили программу фармацевтики со степенью,
диплом или аттестат по аптеке (на уровне бакалавра
степень или ее эквивалент) признаны соответствующими
гражданские органы юрисдикции, в которой школа
расположен как отвечающий требованиям образования для поступления
на практике в этой юрисдикции.
Требования к экзаменам
Вы должны сдать все три части экзамена на получение лицензии фармацевта. серий за 5 лет:
- Часть I: Лицензирование фармацевтов в Северной Америке Экзамен (NAPLEX)
- Часть II: Юриспруденция нескольких государственных аптек Экзамен (MPJE) [Учебное пособие]
- Часть III: Практика рецептурных рецептур и фармацевтики
ИЛИ 1 сентября 2009 г. или позднее получить Сертификат о завершении компетенции резидентуры в фармацевтической практике
НАПЛЕКС (Часть I)
- Требования к поступающим
Для допуска к экзамену необходимо:
- подайте заполненную заявку на лицензию (Форма 1 и плату) в Департамент образования штата Нью-Йорк и
- предоставить документы о законченном образовании и одобрено Департаментом образования штата Нью-Йорк.
- Порядок подачи заявления на экспертизу
Если вы соответствуете перечисленным требованиям для поступления, подайте онлайн-заявку на www.nabp.pharmacy . НАБП будет отправьте вам разрешение на тестирование (ATT) после того, как штат Нью-Йорк подтверждает ваше право на участие в NABP.
Национальная ассоциация фармацевтических советов (NABP)
1600 Feehanville Drive
Mount Prospect, IL 60056
Телефон: 847-391-4406
Интернет: www.набп. аптека - баллов за экзамены / результаты тестов
Вы можете просмотреть свои оценки NAPLEX и / или MPJE онлайн. Эта услуга предоставляется Национальной фармацевтической ассоциацией (NABP) и доступна на их веб-сайте www.nabp.pharmacy.
Несмотря на то, что теперь у вас будет доступ к своим оценкам гораздо раньше, до выдачи официальной лицензии все еще требуется обычное время обработки в три недели.
Вы можете проверить систему проверки лицензий Офиса профессии на сайте www.op.nysed.gov/opsearches.htm, чтобы узнать, была ли выдана ваша лицензия. Информация обновляется ежедневно.
Если сдача NAPLEX или MPJE является вашим заключительным компонентом экзамена и прошло более трех недель, а лицензия не была выдана, вам следует связаться с отделом предварительного лицензирования, отправив электронное письмо по адресу [email protected] или позвонив по телефону 518-474- 3817, доб 250.
MPJE (Часть II)
- Требования к поступающим
Для допуска к экзамену необходимо:
- подайте заполненную заявку на лицензию (Форма 1 и плату) в Департамент образования штата Нью-Йорк, если вы не уже отправленный;
- предоставить документы о законченном образовании и одобрено Департаментом образования штата Нью-Йорк, если вы еще не; и
- представить информацию о вашем завершенном опыте стажировки и
утверждены (Примечание: выпускники PharmD освобождены от
из требований к опыту; см. стажировку
Раздел Требования к опыту для получения дополнительной информации)
Департаментом образования штата Нью-Йорк следующим образом:
- Выпускники аккредитованных программ ACPE или программ, аккредитованных CCAPP (с 1993 г.) должны предоставить документацию о завершении 6 месяцев (1040 часов) утвержденной стажировки в соответствии с требованиями перечислено в разделе «Опыт» Требования.
- Выпускники неаккредитованных программ должны иметь проходной балл по Части I и представить документацию о завершении 12 месяцев (2,080 часов) утвержденной стажировки в соответствии с перечисленными требованиями под опытом Требования.
- Порядок подачи заявления на экспертизу
Если вы соответствуете перечисленным требованиям для поступления, подайте онлайн-заявку на www.набп. аптека . НАБП будет отправьте вам разрешение на тестирование (ATT) после того, как штат Нью-Йорк подтверждает ваше право на участие в NABP.
Национальная ассоциация советов фармацевтов (NABP)
1600 Feehanville Drive
Mount Prospect, IL 60056
Телефон: 847-391-4406
Веб-сайт: www.nabp.pharmacy - баллов за экзамены / результаты тестов
Вы можете просмотреть свои оценки NAPLEX и / или MPJE онлайн. Эта услуга предоставляется Национальной фармацевтической ассоциацией (NABP) и доступна на их веб-сайте www.набп. аптека.
Несмотря на то, что теперь у вас будет доступ к своим оценкам гораздо раньше, до выдачи официальной лицензии все еще требуется обычное время обработки в три недели.
Вы можете проверить систему проверки лицензий Офиса профессии по адресу www.op.nysed.gov/opsearches.htm, чтобы узнать, была ли выдана ваша лицензия. Информация обновляется ежедневно.
Если сдача NAPLEX или MPJE является вашим заключительным компонентом экзамена и прошло более трех недель, а лицензия не была выдана, вам следует связаться с отделом предварительного лицензирования, отправив электронное письмо на адрес opunit1 @ nysed.gov или по телефону 518-474-3817, доб 250.
Приготовление рецептурных препаратов и фармацевтическая практика (Часть III)
- Требования для зачисления
- Для допуска к экзамену необходимо выполнить все квалификационные требования для Части II (MPJE).
- Если вы учитесь в последнем семестре и поступили в Новую Аптечная школа штата Йорк, ваша школа автоматически предоставьте нам предварительный список выпускников.
- Если вы учитесь в последнем семестре и поступили в ACPE аккредитованная аптечная программа, вы должны запросить свое учреждение отправить Форму 2 (Сертификат о профессиональном образовании) непосредственно по адресу, указанному в форме до крайний срок подачи заявки на экзамен. По окончании школы новый Форма 2 или официальный транскрипт со степенью и присвоением Дата должна быть отправлена прямо из школы.(Мы не можем подтвердите свое право на сдачу экзамена, пока мы не получим Форма 2 с указанием предполагаемой даты выпуска.)
- Порядок подачи заявления на экспертизу
Зарегистрируйтесь на экзамен онлайн или просмотрите Инструкции по тестированию, Системные требования и Образец теста на сайте www.scantron.com/programs/nysed-pharmacy/.
- Сроки подачи заявок на экспертизу
Сроки подачи заявок и пошлины в ОБЕИХ Новых Департамент образования штата Йорк и Scantron Assessment:
Если вы хотите сдать экзамен в: Ваши заполненные заявки должны быть штамп на почтовой марке: январь 1 ноября предыдущего года июнь * 1 апреля того же года Если вам необходимо предоставить документацию (Форма 4) на 1040 часов стажировки для допуска к экзамену по Части III, Форма 1 и Форма 4 должны быть представлены в Департамент до указанного выше срока.
- Часть III экзамена Формат:
- Обследование под электронным управлением.
- Продолжительность три часа (перерыв во время экзамена не будет).
- Перерывы в туалете не допускаются.
- Кандидаты могут использовать базовый калькулятор с 4 функциями, встроенный в программу сдачи экзаменов. Никакой другой калькулятор использовать нельзя.
- Во время исследования нельзя использовать бумагу для заметок.
- Кандидаты могут использовать неэлектронную доску для сухого стирания и маркер для вычислений. Перед началом исследования доску для сухого стирания необходимо протереть.
- Никакие документы или другие ссылки в любой форме не могут находиться в комнате, где проводится экзамен.
- Для целей экспертизы Департамент будет получать и проверять информацию о лекарствах по крайней мере из следующих источников: Facts & Comparisons, Lexi-Comp, Micromedex, вкладыш в упаковке или AHFS Информация о лекарствах, а также обязательные главы USP / NF.
- Примерный состав экспертизы:
Категория испытаний Домен компетенции аптек Процент теста Приготовление рецептурных смесей - Приготовление стерильных рецептур и методика
- Приготовление и методика нестерильной рецептуры
- Аптечные расчеты
- Знание действующих в настоящее время глав Фармакопеи США, имеющих отношение к фармацевтической практике
60% Аптека - Правила безопасности при приеме лекарств
- Точность дозирования
- Закон штата Нью-Йорк об аптеках
- Федеральный закон об аптеках
- Фармацевтическая практика, определяемая как введение, приготовление, приготовление, хранение или выдача лекарств, медикаментов и терапевтических устройств
40% Итого за экзамен 100%
Будущие даты экзаменов, Часть III
- 8 июня 2021 г.
- 4 января 2022 г.
- 7 июня 2022 г.
Повторное обследование
Если вам необходимо пересдать какую-либо часть лицензионного экзамена, подайте повторно только соответствующему администратору экзамена.НЕ отправляйте еще одну лицензию заявление и сбор в Государственный департамент образования.
Разумные условия тестирования
Все кандидаты, запрашивающие специальные условия тестирования для NAPLEX, MPJE и Часть III: Письменная и практическая (Составление) экзамены должны заполнить форму запроса штата Нью-Йорк на Разумные приспособления для тестирования и подтверждающая документация по поставкам их просьба.Запрос Форму можно получить онлайн или по адресу [email protected], или по телефону (518) 474-3817 доб. 290 или по факсу (518) 473-8577. Департамент по согласованию с НАБП рассмотрит все запросы. Своевременное представление вашего запроса о разумных приспособлениях а вспомогательная документация поможет предотвратить задержку вашего тестирования процесс.
Требования к опыту
Ограниченное (стажерское) разрешение должно быть выдано для практики аптека под присмотром.Вы должны подать заявку и получить, разрешение на стажировку до начала вашей практики в контролируемой аптеке. Все абитуриенты, кроме выпускников аккредитованных программ ACPE, ведущих для получения степени доктора фармацевтических наук необходимо пройти стажировку.
Вам может быть предоставлен кредит на стажировку, завершенную в других штатах, если стажировка соответствует требованиям штата Нью-Йорк и другого штата как указано в Форме 4.
Ограниченное (внутреннее) разрешение
Любой, кто не подал заявку и не получил разрешение на стажировку от Управление профессий Государственного фармацевтического совета не уполномочено начать стажировку в Нью-Йорке, и кредит не будет предоставлен для такой практики. Только стажировки в зарегистрированной аптеке приемлемы.
Наставник берет на себя ответственность за обучение стажера. даже если стажер может иногда практиковать под присмотром другого фармацевта в той же аптеке.
Если разрешение на стажировку потеряно или повреждено, отправьте письмо в штат Аптечный совет потребует замены. Пожалуйста, укажите свой имя, адрес, номер социального страхования и номер телефона.
Кредит на стажировку для иностранных выпускников и досрочное зачисление на экзамен по части III
Нью-Йорк принимает накопленные часы стажеров в дополнение к часам, необходимым как для вводной, так и для продвинутой практики по учебной программе ACPE по фармации.Нью-Йорк не принимает часы работы клерком или экстерном, которые являются частью школьной программы и необходимы для получения степени. Кредит не может быть предоставлен за часы, превышающие 40 часов в неделю. Для целей расчета неделя считается 7-дневным периодом, а один месяц равен 173 часам.
Стажировка, завершенная в другом штате, может быть принята, если стажер отвечает всем требованиям для фармацевтической практики и уполномочен на это Аптечным советом этого штата. Перед тем, как начать стажировку в другом штате, узнайте в Управлении совета штата, что вы соответствуете их требованиям, и что они смогут подтвердить количество часов, которые вы накопите в Нью-Йорке.
Если вы уже прошли стажировку в другом штате, запросите подтверждение у совета штата, которое будет отправлено непосредственно в Департамент образования штата Нью-Йорк. Подтверждение должно включать подробное описание стажировки, а также даты начала и окончания каждой сессии. Если вы также посещали школу в другом штате, мы требуем, чтобы ваша школа предоставляла нам письмо с указанием даты начала и окончания каждого семестра, в котором вы учились.
Иностранные выпускники
Ваша стажировка должна быть одобрена, прежде чем вы сможете принять участие в Части II (MPJE) и / или Части III (письменной и практической) серии лицензионных экзаменов.Кроме того, сертификат о прохождении стажировки (Форма 4) должен быть представлен в Департамент до крайних сроков подачи заявок на экзамен по Части III: 1 ноября для январского экзамена и 1 апреля для июньского экзамена.
Досрочное зачисление на экзамен по части III
Подача свидетельства о прохождении стажировки в аптеке (форма 4), подтверждающая 1040 Часы стажировки необходимы для раннего допуска к экзамену по Части III. В заполненная Форма 1 и Форма 4 должны быть поданы вместе в Департамент до крайнего срока подачи заявок на экзамен по Части III: 1 ноября для январского экзамена.
На июньский экзамен 2019 никто не будет допущен из расчета 1040 часов стажировки. Только кандидаты, которые уже закончили учебу или выполнили свои академические требования в течение летнего семестра 2019 года и закончат обучение не позднее сентября 2019 года, как это подтверждено их колледжем или университетом, будут допущены к экзамену в июне 2019 года.
Свидетельство о прохождении стажировки в другом государстве
Аптечный совет штата Нью-Йорк не предоставляет свидетельство или подтверждение часов стажировки или клинического опыта.Все выпускники аккредитованных колледжей и фармацевтических школ должны пройти как вводную, так и продвинутую ротацию в аптеках. Завершение этих часов практики / практики контролируется колледжами. Аптечный совет штата Нью-Йорк не проводит независимую проверку или повторное подтверждение этого опыта. Кроме того, считается, что все выпускники аккредитованных программ с PharmD выполнили все практические требования для получения лицензии в штате Нью-Йорк. По этим причинам мы не можем независимо сертифицировать клинический опыт для фармацевтических советов других штатов.
Разрешение на стажировку требуется для всех студентов, участвующих в ротации передовых практик и во время практики в качестве стажера под наблюдением лицензированного фармацевта. Считается, что наши выпускники PharmD проработали не менее 1500 часов стажировки. Проверить разрешение на стажировку можно на нашем веб-сайте: www.op.nysed.gov/opsearches.htm.
Заявители, имеющие лицензию в другом штате *
Требования, необходимые для того, чтобы стать лицензированным фармацевтом в штате Нью-Йорк на основании лицензии в другом штате, следующие:
- Заполните и отправьте Заявление на получение лицензии (Форма 1) вместе с платой в размере 339 долларов США за лицензию и первую регистрацию.Если заявитель является иностранным выпускником, также заполните Сертификат о профессиональном образовании (Форма 2) — Раздел 1 и затем отправьте его в соответствующее учебное заведение. Школа заявителя должна заполнить Раздел 2 и вернуть форму вместе с транскриптами по адресу, указанному в нижней части страницы 3 заявления.
- Заполните предварительную заявку NABP на передачу фармацевтической лицензии и отправьте ее в NABP. Предварительную форму заявки можно получить на сайте www.nabp.pharmacy или позвонив в NABP по телефону 847-391-4406.Официальное заявление NABP будет отправлено вам по почте с инструкциями 1 для подачи этого заявления в Управление профессий, Государственный совет по фармацевтике.
- Кандидаты должны иметь в течение пятилетнего периода, предшествующего подаче заявки, как минимум один год удовлетворительного опыта после получения первоначальной лицензии.
- Ваш работодатель должен предоставить письменное подтверждение на фирменном бланке компании за один полный год (12 месяцев на постоянной основе или эквивалент, если на неполный рабочий день) лицензированной практики.Это подтверждение должно быть отправлено вашим работодателем непосредственно в офис совета директоров по адресу:
Департамент образования штата Нью-Йорк
Управление профессий
Аптечный совет штата
89 Вашингтон-авеню
Олбани, Нью-Йорк 12234-1000
Телефон 518-474-3817 доб. 130
Факс: 518-473-6995
Эл. Почта: [email protected] - После подачи и утверждения вышеуказанных материалов заявки вы получите письмо и инструкции по подаче заявления в NABP для сдачи экзамена MPJE (Часть II).
- Сдать Часть II — Экзамен по юриспруденции в нескольких государственных аптеках (MPJE). Полезную информацию и ссылки на применимые законы и постановления можно найти в нашем учебном пособии.
1 ПРИМЕЧАНИЕ. Если в инструкциях NABP указано, что вы должны заплатить лицензионный сбор, и вы уже отправили его вместе с формой 1, вам не нужно платить дополнительный лицензионный сбор.
* Калифорнийские лицензиаты, не прошедшие NAPLEX, канадские лицензиаты и выпускники зарубежных фармацевтических программ должны связаться с Фармацевтическим советом штата (см. Выше) для получения дополнительной информации об одобрении.
Абитуриенты с иностранным образованием
Требования, необходимые для того, чтобы стать лицензированным фармацевтом в штате Нью-Йорк на основании иностранного образования, следуют в порядке необходимого завершения :
- Сдать экзамен на соответствие иностранным аптекам (FPGEE) и экзамен по английскому как иностранному языку (TOEFL iBT) и получить сертификат экзаменационного комитета иностранных аптек (FPGEC). Информацию об этом экзамене можно получить в Национальной ассоциации фармацевтов (NABP) на сайте www.набп. аптека.
- Заполните и отправьте Заявление на получение лицензии (Форма 1) вместе с платой в размере 339 долларов США за лицензию и первую регистрацию.
- Заполните Раздел 1 Сертификата о профессиональном образовании (Форма 2) и отправьте его в соответствующее учебное заведение и попросите их заполнить и отправить форму вместе с любой другой необходимой документацией в Департамент.
- Сдать экзамен на получение лицензии фармацевта в Северной Америке (NAPLEX). Подайте заявку на сайте www.nabp.com.аптека. NABP отправит вам разрешение на тестирование (ATT), как только штат Нью-Йорк подтвердит ваше право на участие в NABP.
Национальная ассоциация советов по фармацевтике (NABP)
1600 Feehanville Drive
Mount Prospect, IL 60056
Телефон: 847-391-4406
Интернет: www.nabp.pharmacy - Заполните и подайте заявление на получение ограниченного (стажерского) разрешения (форма 5). Вы должны получить разрешение на стажировку, прежде чем заниматься контролируемой аптекой в штате Нью-Йорк.
- Завершите один год (2 080 часов) стажировки.Дополнительную информацию можно найти в разделе «Требования к опыту».
- Заполните и отправьте свидетельство о прохождении стажировки в аптеке (форма 4).
- Сдать Часть II — Экзамен по юриспруденции в нескольких государственных аптеках (MPJE) и Часть III — Письменный и практический экзамен по компаундам.
Видео: Краткий обзор процессов лицензирования на входе и выходе
Дэвид Скотт, эксперт-инструктор курса Курс выдачи лицензий на фармацевтическую продукцию .
В видео ниже Дэвид кратко объясняет процесс лицензирования фармацевтической продукции, который включает как внешнее, так и внутреннее лицензирование.Он состоит из 8 отдельных и последовательных шагов, самый важный из которых — первый: стратегия лицензирования. Как и в случае с любым бизнес-процессом: если вы не знаете, куда идете с самого начала, единственная уверенность в том, что вы не добьетесь этого! Эта стратегия определит, на какие продукты компания может стремиться получить внутреннюю или внешнюю лицензию.
Необходимые подготовительные шаги будут отличаться для действий по внутреннему и внешнему лицензированию, поскольку внешнее лицензирование предполагает продажу продукта, а внутреннее лицензирование предполагает продажу компании в качестве партнера.Процессы встречаются, когда лицензиар и лицензиат устанавливают контакт для изучения возможностей партнерства. Успешный результат может быть улучшен, если следовать хорошо спланированному процессу контактов, но он всегда должен быть достаточно гибким, чтобы допускать интуитивную прозорливость — шанс незапланированных контактов с потенциальными партнерами.
После того, как возможность определена, два действия будут выполняться параллельно: оценка и комплексная проверка продукта и потенциального лицензионного партнера, а также юридические процессы, которые включают согласование условий и полного соглашения.Правильное управление этой деятельностью может иметь большое значение для обеспечения успешного результата. Конечно, подписание сделки — это скорее начало, чем конец процесса, и успешные сделки всегда будут зависеть от четкой стратегии реализации, которая гарантирует, что оба партнера могут получить от сделки то, что они ищут.
Последнее обновление: июль 2021 г.
➤ Дополнительная информация о курсе по внешнему лицензированию фармацевтических препаратов
➤ Дополнительная информация о других курсах по развитию и лицензированию фармацевтического бизнеса
Практическая дорожная карта для перехода государственных лицензий на продажу рецептурных препаратов и устройства в корпоративных операциях
Введение
Фармацевтические компании, такие как производители, дистрибьюторы и аптеки, которые распределяют, распространяют и продают рецептурные лекарства и устройства, подлежат государственному лицензированию и другим нормативным требованиям.Корпоративные операции с участием этих компаний, включая слияния, поглощения, смену владельцев или даже корпоративную реструктуризацию, могут инициировать требование о переходе или получении новых лицензий помимо многих других корпоративных и налоговых вопросов, которые также имеют значение. Более того, существует множество ловушек для неосторожных лиц, несоблюдение требований государства по передаче этих лицензий, что может задержать корпоративную транзакцию или привести к потенциальному приостановлению полномочий на ведение бизнеса.
Фармацевтические компании обязаны поддерживать эти государственные лицензии в качестве производителей, дистрибьюторов и т. Д. В каждом из штатов, в которых расположены их предприятия, и в большинстве штатов, в которых их продукция поставляется или продается. Эти государственные лицензии могут показаться незначительной проблемой в общей структуре крупной сделки, но они представляют собой важную нормативную деталь, которую необходимо учитывать, чтобы новая компания могла вести бизнес и завершить сделку. Таким образом, покупатель должен разобраться в законах и правилах лицензирования почти каждого (если не всех) из 50 штатов и округа Колумбия, чтобы гарантировать, что приобретенная компания продолжит законную деятельность в каждой юрисдикции после смены владельца. .
Подача соответствующих заявлений и уведомлений о смене владельца, а также ожидание ответа от государства — это своевременный процесс, и многие компании удивляются, когда они достигают крайнего срока закрытия, но все еще ждут разрешения на продолжение ведения бизнеса. в определенных штатах. В мире корпоративных транзакций, где беспрепятственный переход операций является необходимостью, такие задержки могут вызвать озабоченность со стороны регулирующих органов, а также логистические трудности и перерывы в работе сторон (и их клиентов).
В этой статье исследуются проблемы лицензирования, с которыми сталкиваются покупатели, и обсуждаются изменения в законах штата, которые влияют на требования о смене владельца. Анализ и рекомендации, представленные в этой статье, применимы как к обычным государственным фармацевтическим лицензиям, так и к лицензиям на вещества, контролируемые государством. Покупатели должны иметь в виду, что лицензии на контролируемые вещества часто выдаются отдельными государственными агентствами. В этой статье также описываются риски несоблюдения этих законов о лицензировании и приводится практическая дорожная карта для решения этих проблем, чтобы помочь избежать нарушения бизнес-операций или дисциплинарных мер штата.
Для целей этой статьи все соответствующие государственные лицензирующие агентства называются «аптечными советами». Однако многие из этих агентств работают под разными названиями, или в штате может быть агентство, которое регулирует фармацевтическую практику, и отдельное агентство, которое регулирует производство или распространение фармацевтических продуктов.
Также важно отметить, что в соответствии с Федеральным законом о безопасности цепочки поставок лекарств (DSCSA) FDA обязано внедрить национальные стандарты лицензирования оптовых дистрибьюторов и сторонних поставщиков логистических услуг (3PL) до 31 декабря 2016 г. ( см. 21 U.S.C. §§ 360eee-2–3). Хотя эти правила внесут некоторые изменения в порядок лицензирования в будущем, штаты продолжат сохранять лицензионные полномочия в отношении фармацевтических компаний.
Три важных вопроса
Когда вот-вот произойдет смена владельца фармацевтической компании, есть три основных вопроса, на которые покупатель должен быть в состоянии ответить.
1. Есть ли у продавца все необходимые лицензии для каждого штата, в котором он ведет бизнес?
Ответ на этот вопрос должен быть определен в течение периода проверки до того, как будет сделано предложение, потому что это может повлиять на стоимость сделки и возможность покупателя потратить ресурсы не только на передачу существующих лицензий, но и потенциально. для получения «просроченных» лицензий в некоторых штатах.Последнее может также повлечь за собой потенциальные штрафы, как описано ниже.
Наличие у компании-продавца всех необходимых лицензий зависит от законодательства штата и толкования этого закона соответствующим комитетом аптек, а также от вида деятельности, которую компания ведет в каждом штате. Например, простое указание названия компании в качестве производителя на этикетке продукта может потребовать наличия лицензии производителя или дистрибьютора-нерезидента в штате, где этот продукт продается, тогда как в некоторых штатах может не потребоваться лицензия дистрибьютора-нерезидента, за исключением случаев, когда у государственного дистрибьютора есть торговые представители в этом штате.
Как правило, лицензия дистрибьютора требуется в большинстве, если не во всех, штатах, в которые дистрибьютор физически отправляет свою продукцию, и в большинстве штатов также требуется, чтобы производители сохраняли лицензию в той или иной форме, если их продукция продается в этих штатах. Отсутствие у продавца соответствующей лицензии должно влиять на оценку покупателем общего регуляторного риска.
2. Какой тип транзакции происходит?
Существует несколько форм структур сделок, каждая из которых, вероятно, построена для оптимальной стоимости, обязательств и налоговых целей для конкретной сделки.Хотя государственные органы редко вникают в каждый аспект этих структур, некоторые основные детали могут определить, произойдет ли смена собственника на самом деле в соответствии с законодательством штата, и если да, то какое влияние эта смена собственника окажет на лицензионные требования. Например, большинство штатов захотят узнать, остались ли имя, идентификационный номер федерального налогоплательщика и адрес прежними. Кроме того, они захотят узнать, включает ли сделка покупку активов или покупку акций.В случае покупки акций штаты должны знать процент акций, владельцы которых меняются.
На практике покупка акций, при которой название компании, налоговая идентификация и идентификационные данные остаются неизменными, менее обременительна с точки зрения передачи лицензий в различных штатах. Приобретение активов и создание новых компаний обычно требует подачи заявки на получение новой лицензии. Эти требования более подробно обсуждаются ниже.
3.Требует ли штат новая лицензия или достаточно ли уведомления об обновлении записей штата?
Для тех штатов, в которых предприятие продавца имеет лицензию, покупатель должен определить, должен ли он подать заявку на новую лицензию на объект или все, что требуется, — это уведомление об изменении владельца в какой-либо форме. Ответ на этот вопрос зависит от множества факторов, включая структуру сделки, закон штата (если он есть) и толкование своих законов советами аптек.Хотя большинство государственных лицензионных органов поддерживают веб-сайт, содержание и детали, касающиеся необходимых требований, различаются в зависимости от штата, и часто самый важный вопрос, то есть, сколько времени потребуется для обработки смены владельца, не предоставляется.
Таким образом, многие покупатели должны напрямую связываться с комитетом аптек, чтобы сообщить подробности своих транзакций, чтобы обеспечить соблюдение требований каждой аптеки. Юридические фирмы или консультанты по государственному лицензированию могут предоставить покупателям эту информацию на основе анализа нормативных требований, а также знаний и опыта в этих сделках.Как описано в следующем разделе, требуемое действие (например, новое приложение или уведомление) зависит от состояния и может существенно повлиять на переход бизнес-операций после закрытия сделки.
Изменения в требованиях штата о смене собственника
Существуют три основные категории штатов, когда речь идет о требованиях к лицензированию смены владельца. В некоторых штатах требуется только, чтобы учреждение посредством своего нового владельца уведомляло соответствующий совет аптеки о смене владельца (состояния уведомления).В некоторых штатах требуется подача заявки на новую лицензию, но разрешают предприятию продолжать работу по старой лицензии, пока заявка находится на рассмотрении, если заявка получена в течение определенного периода до или после закрытия (продолжающаяся работа или состояния CO). Небольшая горстка штатов также требует подачи заявки на новую лицензию, но не позволяет продолжать работу после закрытия, пока приложение находится на рассмотрении (непродолжительные операции или состояния, не относящиеся к CO).
Аптечные советы в штатах, не входящих в СО, строго следят за своими фармацевтическими законами, которые требуют надлежащего лицензирования, чтобы заниматься любой формой производства, распределения или аптечной практики в своих штатах, даже если объект и его деятельность были полностью лицензированы. под старым владением.Известные штаты, не относящиеся к CO, включают Калифорнию, Флориду, Мэн, Мэриленд и Орегон. Страны, не входящие в состав CO, представляют собой наиболее серьезные проблемы для покупателей, которым требуется беспрепятственное продолжение операций после закрытия.
Логистика и сроки
Корпоративные транзакции часто контролируются строгими графиками, которые создаются при подписании и достигают высшей точки при закрытии. В течение этого периода времени покупатель должен работать с продавцом для подачи заявки на новые лицензии (или, при необходимости, подавать уведомления), чтобы осуществить смену владельца лицензированного объекта.Этот процесс может занять много времени по нескольким причинам.
Во-первых, приложения могут быть длинными и запрашивать информацию, на получение которой потребуется время, включая информацию о владельцах, сотрудниках, клиентах и продуктах. Например, в некоторых штатах необходимая справочная информация варьируется от личного места жительства представителя, полученного семь лет назад (см. Аптечный округ штата Айдахо, Заявление о личной информации назначенного представителя; Аптечный департамент штата Мэриленд, Заявление на получение разрешения оптового дистрибьютора), на личные адреса проживания, номера социального страхования и даты рождения директоров, должностных лиц или владельцев учреждения (см., e.г., штат Флорида, автобусный вокзал. & Prof’l Regulation, Заявка для оптового продавца рецептурных лекарств за пределами штата; N.Y. State Bd. аптеки, заявление на первичную регистрацию или передачу права собственности на производителя, переупаковщика и / или оптовика лекарств, рецептурных или медицинских газов). Некоторые приложения задают конкретные вопросы о клиентах учреждения (см., Например, «NM Bd. Of Pharmacy», «Заявление оптового дистрибьютора лекарств») или требуют полного описания объекта, включая его площадь в квадратных футах, системы сигнализации, а также средства контроля температуры и влажности (см. , д.г., Государство Дел. Бд. Аптеки, Заявление о разрешении дистрибьютора (аптеки-опт); Md. Bd. Аптеки, Заявление о разрешении оптового дистрибьютора). Суть в том, что эти приложения требуют подробных знаний о приобретаемом или планируемом к покупке объекте, его операциях и управлении, а также о новом владельце.
Во-вторых, во многих штатах также требуется, чтобы определенный персонал проходил проверку на наличие судимости (включая снятие отпечатков пальцев). На практике для обработки этих проверок в некоторых штатах может потребоваться до двух месяцев и больше.Многие аптечные советы передают эту проверку биографических данных другим федеральным агентствам или агентствам штата или частным подрядчикам.
В-третьих, у многих советов аптек не хватает персонала и они работают со значительным отставанием. В результате для рассмотрения заявки и выдачи новой лицензии в некоторых штатах может потребоваться от восьми до десяти недель.
В-четвертых, некоторые аптеки не выдадут новую лицензию до тех пор, пока не будет заключено соглашение между покупателем и продавцом. Если заявки поданы раньше, эти аптечные советы, вероятно, рассмотрят заявки, но они будут ждать выдачи новых лицензий, пока не получат окончательный счет купли-продажи или другой аналогичный заключительный документ.
Наконец, большинство советов аптек не выдают новую лицензию до тех пор, пока штат, в котором находится предприятие (называемый родным штатом или штатом резидента), не выдаст новую лицензию.
Все эти факторы показывают, почему новому владельцу может быть сложно иметь все лицензии на его недавно приобретенные объекты, чтобы продолжить работу в каждом штате сразу после закрытия, особенно при работе в рамках сокращенного графика закрытия. Такие покупатели могут столкнуться со следующими вопросами: что, если все новые лицензии не будут выданы при закрытии или при закрытии? Следует ли предприятию прекратить работу в штатах, в которых он все еще ожидает выдачи новых лицензий? Какой риск не сделать этого? Что произойдет с его клиентами в штатах, в которых предприятие прекращает работу, пока его заявки ожидают рассмотрения после закрытия?
Эти вопросы, безусловно, могут вызвать смущение у покупателя по мере приближения крайнего срока закрытия, когда покупатель все еще ожидает получения новых лицензий на смену владельца от многочисленных советов аптек в юрисдикциях, где предприятие ведет свою деятельность.Эти компании обеспокоены любым нарушением бизнеса и его влиянием на отношения с клиентами и общий объем продаж.
Что делать новому владельцу, если он все еще ожидает выдачи лицензий после закрытия?
Прежде чем ответить на этот вопрос, полезно сделать шаг назад и взглянуть на общую картину. Большинство состояний, как обсуждалось выше, являются состояниями уведомления или состояниями CO. Это означает, что, если покупатель делает соответствующие уведомления и своевременно отправляет свои новые заявки, он может продолжить свои операции в этих состояниях после закрытия.Другими словами, сбоев в работе объекта в этих штатах не будет.
Однако есть несколько штатов (т.е. штаты, не относящиеся к CO), где аптечные советы не разрешают предприятию работать в их штатах после закрытия, пока предприятие не получит новые лицензии. Если лицензия не была выдана в этих штатах к моменту закрытия или при закрытии, предприятие должно прекратить свою хозяйственную деятельность в этом состоянии. На протяжении многих лет, общаясь с персоналом аптечного совета, аптечный совет в штатах, не являющихся членами CO, рассматривает продолжение операций после закрытия без новой лицензии как несанкционированную практику аптек, производства, распределения и т. Д.(т. е. незаконная деятельность в соответствии с законодательством штата или другими соответствующими законами). В большинстве штатов такая деятельность является основанием для отзыва лицензии или отклонения заявки (см., Например, Cal. Bus. & Prof. Code §§ 4161, 4304; Md. Code Ann., Health Occ. §§ 12- 601, 12-6C-03 (a)) и может повлечь за собой гражданские санкции (см., Например, Md. Code Ann., Health Occ. § 12-6C-11 (a)). Соответственно, после закрытия сделки новый покупатель объекта должен прекратить операции в каждом государстве, не являющемся СО, до тех пор, пока он не получит соответствующую лицензию.
Риск несоблюдения
Обычный вопрос, который задают многие покупатели в такой позиции: какой существует риск, если таковой существует, для продолжения операций в штатах, не относящихся к CO, в то время как новые заявки все еще находятся на рассмотрении после закрытия.
Нам известно о фармацевтических советах и других государственных лицензионных органах, принимающих принудительные меры против компаний за деятельность в их штатах без лицензии для нерезидентов (см., Например, Final Consent Order, In re Calvin Scott & Company, Inc., Дело № PI 11-115 (Md. Bd. Pharmacy, 9 апреля 2013 г.) (взыскание штрафа и формальных дисциплинарных мер за распространение рецептурных лекарств в Мэриленде без разрешения оптового дистрибьютора Мэриленда). Похоже, что существует меньший риск принудительных действий в отношении компаний, продолжающих деятельность по своим старым лицензиям в течение короткого периода времени, ожидая выдачи их новых лицензий на смену владельца. Конечно, штаты могут использовать некоторые правоприменительные меры по своему усмотрению, когда компания предприняла добросовестные усилия для своевременной подачи уведомления / заявки на смену владельца.Тем не менее, очевидно, что существует риск правоприменения, и его нельзя игнорировать. Аптечные советы в штатах, не являющихся членами CO, имеют право применять это строгое толкование своих фармацевтических законов. Таким образом, важно понимать требования в каждом штате и общаться с властями штата, чтобы свести к минимуму возможность принятия трудного решения, т. Е. Прекратить доставку в штат или столкнуться с потенциальным штрафом или, что еще хуже, с отказом в принятии решения. заявка, ожидающая рассмотрения.
Некоторые покупатели принимают бизнес-решение о том, что финансовый и репутационный ущерб от прекращения операций после закрытия в любых штатах, не входящих в СО, где заявки еще не рассмотрены, перевешивает риск принудительных действий со стороны аптек в этих штатах.Другие придерживаются консервативного подхода и строго соблюдают законы о лицензировании в этих штатах, особенно если покупатель или приобретенный объект не соблюдают законы штата об аптеках. Третьи могут использовать подход с измерением риска и выбрать либо продолжить, либо временно прекратить продажи в определенном состоянии в зависимости от объема продаж и влияния прекращения поставок на их прибыль.
Потенциальные покупатели, однако, не обязательно должны выбирать между Сциллой прекращения деятельности и Харибдой принятия риска нарушения государственного закона о фармацевтике.Как обсуждается ниже, при надлежащем планировании и координации покупатель может получить все необходимые лицензии для продолжения операций в каждом штате, в котором он ведет бизнес, сразу после закрытия.
Дорожная карта для потенциальных покупателей
Следующая дорожная карта представляет собой практический график действий, которым может следовать потенциальный покупатель, чтобы обеспечить беспрепятственный переход операций во время смены владельца. Эта дорожная карта содержит только предложения, и потенциальные покупатели должны помнить, что детали каждой транзакции могут потребовать внесения изменений в эти предложения.Таким образом, очень важно, чтобы потенциальный покупатель получил совет опытной юридической фирмы или консультанта по государственному лицензированию.
Стадия усердия:
- Получите список всех лицензий аптечного совета, принадлежащих целевому учреждению.
- Определите, есть ли у целевого предприятия все необходимые аптеки и другие соответствующие лицензии в свете его хозяйственной деятельности.
- Если предложение кажется вероятным, определите, какие состояния являются состояниями уведомления, состояниями CO и состояниями не-CO на основе предлагаемых деталей транзакции.
- Определите, в каких штатах также потребуется снятие отпечатков пальцев и проверка биографических данных.
Этап предложения:
- Поставить перед продавцом вопрос о подаче заявки на новые лицензии и объяснить необходимость согласования продавцом с потенциальным покупателем, если и когда сделка дойдет до стадии подписания.
- Если сделка кажется вероятной, начните готовить заявки для штата происхождения и для всех штатов, не относящихся к CO, где требуется лицензирование.Потенциальные покупатели должны заполнить заявки настолько полно, насколько это возможно, а затем составить список необходимой информации от продавца.
- Если речь идет о штатах, не относящихся к СО, договоритесь о периоде закрытия, который учитывает период времени для получения новых лицензий, имея в виду, что в некоторых штатах, не являющихся СО, может потребоваться от восьми до десяти недель для предоставления новой лицензии после получения. приложения.
- Договоритесь о том, чтобы продавец работал с покупателем для подачи всех заявок и уведомлений в соответствии с предложенным графиком на следующем этапе, или назначьте ответственное лицо на предприятии продавца, которое предоставит покупателю всю необходимую информацию.
- Рассмотрите возможность предварительного согласования даты закрытия при успешном получении лицензий во всех штатах, не являющихся СО.
- Рассмотрите возможность получения от продавца заверений и гарантий, касающихся возможности получения соответствующих лицензий до и после закрытия, включая сумму условного депонирования за потерянные продажи, если покупатель не получит соответствующие лицензии при закрытии или в течение определенного периода после закрытия. .
От подписания до заключительных этапов:
- В течение первых двух дней (т.е., немедленно) после подписания:
- завершить и подать заявку на регистрацию и любые заявки, не относящиеся к стране происхождения; и
- готовит и отправляет заявки на проверку биографических данных и карты отпечатков пальцев для каждой аптеки, требующей проверки биографических данных.
- В течение первых двух недель (т.е. как можно скорее) после подписания:
- завершить и подать все заявки штата СО; и
- уведомляет все государства-уведомления о предстоящей дате закрытия и деталях смены владельца (обычно достаточно письма, хотя в некоторых штатах есть специальные формы уведомлений).
- Примечание: Обязательно соблюдайте требования каждого штата к заявкам и уведомлениям, учитывая, что многие штаты требуют, чтобы приложение или уведомление были поданы в течение определенного периода времени, чтобы предприятие продолжало работать в соответствии с текущей лицензией после закрытия.
- Тесно сотрудничать с аптечными советами штата происхождения и штата, не входящего в CO, для подтверждения получения заявок. Многие сотрудники аптечного совета будут работать с вами, чтобы гарантировать, что новая лицензия будет предоставлена при закрытии или перед закрытием, если вы дали им достаточно времени, чтобы рассмотреть ваше заявление и предоставить им заполненные (не частично заполненные) заявки в начале.Если возможно, определите, кто в аптеке будет отвечать за обработку заявления, и убедитесь, что у этого человека есть ваша контактная информация для любых вопросов или отсутствующей информации. Для аптечных советов, которым требуется копия лицензии штата происхождения или окончательного счета купли-продажи, попытайтесь согласовать с ними договор, чтобы лицензия могла быть выдана, как только эти документы станут доступны.
- В день закрытия отправьте окончательный счет продажи (или аналогичный документ) всем аптечным советам, требующим такой документации.
Эта предлагаемая дорожная карта не является гарантией того, что покупатель получит все необходимые разрешения на лицензирование до или при закрытии. Этот процесс больше искусство, чем наука. Это требует знания политики и практики каждого аптечного совета, а также включает в себя определенный человеческий фактор в координации с персоналом аптечного совета.
Заключение
Навигация по любой форме корпоративной транзакции отнимает много времени и требует кропотливой работы.Дополнительная детализация сделок с участием фармацевтических компаний, обеспечивающая получение соответствующей государственной лицензии, добавляет еще один уровень нюансов и сложностей. Эта дорожная карта предоставляет покупателям и их корпоративным консультантам некоторую информацию, необходимую для того, чтобы эти нормативные детали не представляли проблемы после закрытия. В этих сделках покупатели и их консультанты по сделкам должны искать экспертов по регулированию, чтобы они помогли ориентироваться в процессе государственного лицензирования, чтобы избежать дополнительных задержек и затрат при завершении сделки.
Как получить лицензию на наркотики в Индии
Как получить лицензию на наркотики в Индии — Ищете шаги для регистрации для получения лицензии на маркетинг лекарств в Индии? Хотите узнать, как получить оптовую лицензию на лекарства в Индии? В этом посте мы обсудим требования, документы и другие важные моменты, чтобы получить лицензию на маркетинг лекарств в Индии для фармацевтического бизнеса по производству ПХД.
Введение | Лицензия на лекарстваЗакон 1940 года о лекарствах и косметике сделал лицензирование фармацевтических компаний обязательным.Закон объединяет правила и положения, касающиеся лекарств, косметики и медикаментов, и создает Департамент по контролю за наркотиками. Центральная организация по контролю за стандартами на лекарственные средства (CDSCO) является главным должностным лицом Генерального контролера по лекарственным средствам Индии (DCGI). Они являются основным регулирующим органом по регистрации лекарств в Индии.
- Центральная организация по контролю за стандартами на лекарства или
- Государственная организация по контролю стандартов на лекарства
Тип лицензии на лекарство зависит от характера бизнеса и сделки.Вот характеристики лицензии на лекарства в Индии:
- Владеть всеми видами фармацевтических и косметических предприятий обязательно.
- Каждый фармацевтический бизнес (лекарства и косметика) должен соответствовать условиям лицензии.
- Лицензия на маркетинг (продажу) лекарств может быть предоставлена в двух помещениях: коммерческом или другом помещении независимо от места жительства.
- Лицензия должна отображаться в центре помещения.
- Наличие лицензии на лекарство обязательно в каждом штате, если вы работаете в двух или более штатах.
- Тем, кто мигрировал, нужно будет заполнить другую форму.
Лицензии на лекарства бывают трех типов. Один из них — лицензия на производство, лицензия на продажу и лицензия на ссуду. Лицензии на маркетинг лекарственных средств бывают трех типов. Убедитесь, что вы заполнили правильную форму лицензии и передали ее в Департамент по контролю за наркотиками. Можно подать заявку на:
- Лицензия на оптовую продажу лекарств (WDL) (обычно выдается лицам или агентствам, участвующим в оптовой продаже фармацевтических препаратов и продуктов)
- Лицензия на розничные лекарства (RDL) (Обычно выдается отдельным аптекам и аптекам)
- Ограниченный (Gen.Магазин) Лицензия
Действующую лицензию на маркетинг лекарств можно получить, заполнив заявки в соответствии с правилами по лекарствам и косметике 1934 года. Вам необходимо заполнить форму и отправить ее в лицензирующий орган. В списках лекарств, предназначенных для распространения / демонстрации / продажи / продажи / хранения / предложения. Вот список номеров заявок, которые вы должны заполнить:
- Лекарства, не включенные в Список X, необходимо заполнить Форму 19 или Форму 19-A (розничная продажа менее 5000 человек)
- Лекарства, указанные в Списках C, C (1) и X необходимо заполнить форму 20, форму 20-A или форму 20 –B
Требования для получения лицензии на маркетинг лекарств в Индии
Перед подачей заявки на лицензию на лекарство вам нужно будет выполнить некоторые основные требования.Для получения лицензии необходимо соблюдать условия. Взгляните на минимальные требования для получения лицензии на маркетинг лекарств в Индии:
- Помещение должно иметь площадь не менее 10 квадратных метров для аптеки / аптеки или оптовой торговой точки. 15 кв.м под розничный и оптовый бизнес.
- У вас должен быть холодильник и кондиционер для хранения вакцин, инъекций инсулина, сывороток и т. Д.
- Зарегистрированный фармацевт при Государственном совете по аптекам.
- В случае оптового продавца или отсутствия зарегистрированного фармацевта ответственность несет компетентное лицо. Он должен быть выпускником и иметь как минимум 1-летний опыт работы в сфере продаж и маркетинга лекарств.
- Лицо, прошедшее сертификацию S.S.L.C и имеющее 4-летний опыт работы в фармацевтических продажах, также имеет право на участие.
К форме лицензии необходимо будет приложить комплект документов для подтверждения и подтверждения. Документы, предназначенные для заполнения или прилагаемые, могут отличаться от штата к штату.Вот ориентировочный список непатентованных документов, которые необходимо подать вместе с формой для получения лицензии на лекарство в Индии:
- Форма заявки в соответствии с вашими потребностями.
- Чертеж основного плана и планировки помещения. Вам также понадобится письменное подтверждение договора аренды права собственности на помещение. Это основа владения помещением.
- Форма декларации
- Сопроводительное письмо от заявителя с указанием цели заявки с подписью, наименованием и обозначением.
- Плата за подачу чаллана.
- Копия чека-фактуры на приобретенный холодильник и кондиционер.
- Копия оригинала свидетельства о регистрации / AOA / MOA / Партнерского акта
- Копия письма о назначении с подписью и письменными показаниями зарегистрированного фармацевта или компетентного лица (работающего полный рабочий день).
- Аффидевит об отказе от осуждения партнеров / собственников / директоров в соответствии с Законом о наркотиках и косметике 1940 года.
- В случае частной компании с ограниченной ответственностью вам необходимо предоставить решение совета директоров и список директоров с подписью.
- Квитанция об уплате налога на имущество.
- Четыре рупии 2 марки
Перед подачей проверьте все документы и выполните требование. Препарат необходим всем фармацевтам. Законы и правила могут отличаться от штата к штату. Вы можете узнать об этом лучшего мнения у наркологов.
Продолжить чтение
| Форма заявки | Заявка на выдачу лицензии | Лицензирование | Скачать |
| Форма заявки | Заявление о продлении лицензии | Лицензирование | Скачать |
| Форма заявки | Заявление на получение лицензии на производство лекарств для экспериментальных целей | Лицензирование | Скачать |
| Форма заявки | COVID-19 | Лицензирование | Скачать |
| Форма заявки | Covid | Лицензирование | Скачать |
| Уведомление | Порядок лицензирования | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 09.01.2013 по 12.06.2013 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 12.07.2013 по 31.12.2013 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.01.2014 по 31.01.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.02.2014 по 28.02.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 03.03.2014 по 31.03.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-04-2014 по 30-04-2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.05.2014 по 31.05.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.06.2014 по 30.06.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.07.2014 по 31.07.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.08.2014 по 31.08.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.09.2014 по 30.09.2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-10-2014 по 31-10-2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-11-2014 по 30-11-2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-12-2014 по 31-12-2014 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.01.2015 по 31.01.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.02.2015 по 28.02.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.03.2015 по 31.03.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-04-2015 по 30-04-2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.05.2015 по 31.05.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела по обезвреживанию наркотиков с 01.06.2015 по 30.06.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.07.2015 по 31.07.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.08.2015 по 31.08.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.09.2015 по 30.09.2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-10-2015 по 30-10-2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-11-2015 по 30-11-2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-12-2015 по 30-12-2015 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.01.2016 по 31.01.2016 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-02-2016 по 29-02-2016 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.05.2017 по 31.05.2017 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.06.2017 по 30.06.2017 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.09.2017 по 30.09.2017 | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01.04.2018 по 30.06.2018 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 01.08.2017 по 31.08.2018 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 01.10.2018 по 31.10.2018 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 11.01.2018 по 30.11.2018 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 01.12.2018 по 31.12.2018 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 01.01.2019 по 31.01.2019 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 01.07.2019 по 30.09.2019 | Лицензирование | Скачать |
| Деятельность | Список действующих производств лекарственных средств, действующих в Пакистане | Лицензирование | Скачать |
| Деятельность | Отчет отдела лицензирования и протокол 272 заседания Центрального лицензионного совета | Лицензирование | Скачать |
| Деятельность | Деятельность отдела лицензирования лекарственных средств с 01-10-2019 по 31-10-2019 | Лицензирование | Скачать |
| Деятельность | Ежемесячный отчет о проделанной работе за период с 11.01.2019 по 30.11.2019 | Лицензирование | Скачать |
| Протокол встречи | Протокол 232-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 233-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 234-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 235-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 236-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 237-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 238-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 239-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 240-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 241-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 242-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 243-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 244-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 245-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 246-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 247-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 248-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 249-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 250-го заседания Центральной лицензионной комиссии | Лицензирование | Скачать |
| Протокол встречи | Протокол 253-го заседания Центрального лицензионного совета, состоявшегося 15–16 МАЯ 2017 г. | Лицензирование | Скачать |
| Протокол встречи | Ежемесячный отчет / Протокол 255-го заседания Центрального лицензионного совета | Лицензирование | Скачать |
| Протокол встречи | Ежемесячный отчет / протокол Центрального лицензионного совета с 01-10-2017 по 31-10-2017 | Лицензирование | Скачать |
| Протокол встречи | Ежемесячный отчет / протокол Центрального лицензионного совета с 11.01.2017 по 30.11.2017 | Лицензирование | Скачать |
| Протокол встречи | Протокол 259-го заседания Центрального лицензионного совета, состоявшегося 29 и 30 марта 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 251-го заседания Центрального лицензионного совета, состоявшегося во вторник, 6 декабря 2016 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 254-го заседания Центрального лицензионного совета, состоявшегося 15 июня 2017 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 260-го заседания Центрального лицензионного совета, состоявшегося 16 апреля 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 261-го заседания Центрального лицензионного совета от 2 мая 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 252-го заседания Центрального лицензионного совета, состоявшегося в среду, 15 марта 2017 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 256-го заседания Центрального лицензионного совета 09-10 ноября 2017 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 262-го заседания Центрального лицензионного совета от 23 мая 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 263-го заседания Центрального лицензионного совета от 11 июня 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 264-го заседания Центрального лицензионного совета от 9 июля 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Ежемесячный отчет о проделанной работе за период с 01.07.2018 по 31.07.2018 | Лицензирование | Скачать |
| Протокол встречи | Ежемесячный отчет о проделанной работе за период с 01.09.2018 по 30.09.2018 | Лицензирование | Скачать |
| Протокол встречи | Протокол 257-го заседания Центрального лицензионного совета 24-25 января 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 258-го заседания Центрального лицензионного совета 8 марта 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 265-го заседания Центрального лицензионного совета, состоявшегося 9 и 10 августа 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 266-го заседания Центрального лицензионного совета, состоявшегося 24 октября 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 267-го заседания Центрального лицензионного совета, состоявшегося 31 декабря 2018 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 268-го заседания Центрального лицензионного совета от 10 января 2019 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 269-го заседания Центрального лицензионного совета от 26 февраля 2019 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 270-го заседания Центрального лицензионного совета, состоявшегося 23 мая 2019 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 271-го заседания Центрального лицензионного совета от 12 сентября 2019 г. | Лицензирование | Скачать |
| Протокол встречи | Протокол 272 заседания Центрального лицензионного совета (CLB) | Лицензирование | Скачать |
| Протокол встречи | Протокол 273-го заседания Центральной лицензионной комиссии от 15 января 2020 г. | Лицензирование | Скачать |
| СРО | Поправки к Правилам в отношении лекарственных средств (лицензирование, регистрация и реклама), 1976 г. | Лицензирование | Скачать |