Если лицензия на оптовую торговлю лекарственными средствами отсутствует
Главная → Статьи → Если лицензия на оптовую торговлю лекарственными средствами отсутствует
Аптека отпускает медикаменты юридическим лицам. Лекарственные препараты используются покупателями не для перепродажи, а для лечения пациентов. В имеющейся у продавца лицензии отсутствует указание на возможность осуществлять оптовую торговлю лекарственными препаратами. Имеет ли право аптека отпустить за безналичный расчет медикаменты юридическим лицам, в том числе и медицинским учреждениям?
Согласно п. 1 ст. 49 ГК РФ в случаях, предусмотренных законом, юридическое лицо может заниматься отдельными видами деятельности только на основании специального разрешения (лицензии), членства в саморегулируемой организации или выданного саморегулируемой организацией свидетельства о допуске к определенному виду работ. На основании п. 47 ч. 1 ст. 12 Федерального закона от 04.05.
Под аптечной организацией в Законе № 61-ФЗ понимается организация, структурное подразделение медицинской организации, осуществляющие розничную торговлю лекарственными препаратами, хранение, перевозку, изготовление и отпуск лекарственных препаратов для медицинского применения в соответствии с требованиями Закона № 61-ФЗ (п. 35 ст. 4 этого Закона). По смыслу приведенных и иных положений Закона № 61-ФЗ (в том числе п. 33 ст. 4, ч. 1 и 2 ст. 55, ст. 56 этого Закона), Положения о лицензировании фармацевтической деятельности (утверждено постановлением Правительства РФ от 22.12.2011 № 1081), аптечные организации принципиально (при наличии соответствующего указания в лицензии на осуществление фармацевтической деятельности) вправе осуществлять для медицинского применения розничную торговлю лекарственными препаратами, их отпуск (в том числе по требованиям-накладным медицинских организаций), хранение, перевозку и изготовление.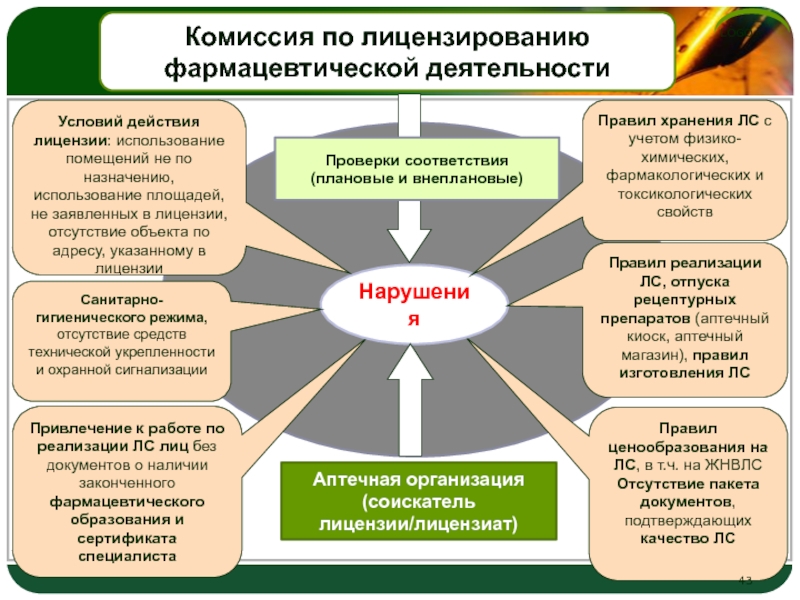
Для осуществления же оптовой торговли лекарственными средствами, к которой относится и продажа лекарственных средств по договорам поставки медицинским организациям, продавец должен иметь лицензию на фармацевтическую деятельность с указанием “оптовая торговля лекарственными средствами для медицинского применения” (п. 34 ст. 2, 53, 54 Закона № 61-ФЗ, п. 2 ст. 2 Федерального закона от 28.12.2009 № 381-ФЗ “Об основах государственного регулирования торговой деятельности в Российской Федерации”, п. 7 Правил оптовой торговли лекарственными средствами для медицинского применения, утвержденных приказом Минздравсоцразвития РФ от 28.12.2010 № 1222н). Аптечные организации, в лицензии которых такое указание отсутствует, не вправе осуществлять поставку лекарственных препаратов (смотрите, в частности, письмо ФАС РФ от 17.07.2013 № АД/27592/13, постановления Арбитражного суда Западно-Сибирского округа от 17.06.2016 № Ф04-2162/16 по делу № А46-10309/2015, Арбитражного суда Центрального округа от 21.
Осуществление ими соответствующей деятельности может явиться основанием для привлечения к административной ответственности (смотрите, например, постановления: Арбитражного суда Северо-Кавказского округа от 12.04.2016 № Ф08-2333/16 по делу № А53-31913/2015 и от 12.08.2015 № Ф08-6082/15 по делу № А63-2554/2015, Арбитражного суда Уральского округа от 11.09.2015 № Ф09-7248/15 по делу № А76-2770/2015, Восемнадцатого арбитражного апелляционного суда от 07.08.2017 № 18АП-8133/170). Обеспечение деятельности медицинских организаций медицинскими препаратами для целей Закона № 61-ФЗ не является розничной торговлей (смотрите, например, постановления Арбитражного суда Уральского округа от 01.09.2017 № Ф09-4630/17 по делу № А50-28224/2016, Семнадцатого арбитражного апелляционного суда от 17.
Ответ подготовил: Котыло Игорь, эксперт службы Правового консалтинга ГАРАНТ
Также читайте:
Цифровая медицина — реальность ближайшего будущего
Врачам предписано выдавать электронные рецепты своим пациентам
С 1 июля 2017 года врачи могут выдавать электронные больничные
Свежие новости цифровой экономики на нашем канале в Телеграм
| Нужна электронная подпись для врача? Достаточно оставить заявку.  Мы поможем выбрать нужный в вашем случае тип сертификата электронной подписи, Мы поможем выбрать нужный в вашем случае тип сертификата электронной подписи, | |
| Нужна электронная подпись для маркировки лекарств? Достаточно оставить заявку. Мы поможем выбрать нужный тип сертификата электронной подписи, расскажем как его применить и предоставим другие дополнительные услуги. Оставить заявку >> |
Лицензирование
Сообщить о нежелательной реакции
при применении ветеринарного лекарственного препарата
Информацию об обороте фальсифицированных, недоброкачественных, контрафактных лекарственных средств и при применении лекарственных препаратов для ветеринарного применения: о побочных действиях, не указанных в инструкциях по применению лекарственных препаратов, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях просим направлять по адресу: 236023 г.

Лицензирование фармацевтической деятельности осуществляет отдел внутреннего ветеринарного надзора территориального Управления Россельхознадзора (Калининград, Советский пр. 188В, тел. (4012) 99-01-83, 99-01-84) .
В целях реализации Положения о лицензировании фармацевтической деятельности, утвержденного постановлением Правительства Российской Федерации от 22.12.2011 № 1081 «О лицензировании фармацевтической деятельности», и приказа Российской Федерации от 01.04.2008 № 55 «О лицензировании фармацевтической деятельности», приказом Управления Россельхознадзора по Калининградской области от 04.05.2008 № 124 утверждено Положение о комиссии по лицензированию фармацевтической деятельности. Лицензированию подлежит фармацевтическая деятельность, осуществляемая в сфере обращения лекарственных средств, предназначенных для животных (розничная торговля лекарственными средствами, производство лекарственных средств).
Реестр лиц юридических лиц и/или индивидуальных предпринимателей, получивших лицензию на осуществление фармацевтической деятельности в сфере розничной торговли лекарственными средствами
Объекты государственного надзора, отнесенных к категории значительного риска (в сфере обращения лекарственных средств, для ветеринарного применения)
Федеральная служба по ветеринарному и фитосанитарному надзору во исполнение пункта 5 раздела VIII Протокола заседания Правительственной комиссии по проведению административной реформы от 20.03.2012 № 131 проводит анкетирование заявителей субъектов-получателей государственных услуг, а также заинтересованных лиц и организаций о качестве предоставления Россельхознадзором государственных услуг.
ФГБУ «ВГНКИ» на основании лицензии на право осуществления образовательной деятельности от 09.08.2012 № 0297, выданной Рособрнадзором, реализуется программа повышения квалификации «Правовые аспекты фармацевтической деятельности, осуществляемой организациями в сфере обращения лекарственных средств для ветеринарного применения»
Прекращение действия лицензии на осуществление фармацевтической деятельности / Бизнес / Госуслуги Москвы
Вы можете отправить сообщение в органы исполнительной власти города Москвы в рамках досудебного обжалования.
и действий (бездействия) Департамента и его должностных лиц
1. Заявитель имеет право подать в досудебном (внесудебном) порядке жалобу на принятые (совершенные) при предоставлении государственной услуги решения и (или) действия (бездействие) Департамента и его должностных лиц, государственных гражданских служащих города Москвы.
2. Подача и рассмотрение жалоб осуществляется в порядке, установленном главой 2.1 Федерального закона от 27 июля 2010 г. № 210-ФЗ «Об организации предоставления государственных и муниципальных услуг», Положением об особенностях подачи и рассмотрения жалоб на нарушение порядка предоставления государственных услуг города Москвы, утвержденным постановлением Правительства Москвы от 15 ноября 2011 г. № 546-ПП «О предоставлении государственных и муниципальных услуг в городе Москве», настоящим Регламентом.
3. Заявители могут обратиться с жалобами в случаях:
3.1. Нарушения срока регистрации запроса на предоставление государственной услуги и иных документов, необходимых для предоставления государственных услуг, а также порядка оформления и выдачи описи в получении запроса на предоставление государственной услуги и иных документов (информации) от заявителя.
3.2. Требования от заявителя:
3.2.1. Документов или информации либо осуществления действий, предоставление или осуществление которых не предусмотрено нормативными правовыми актами Российской Федерации и города Москвы для предоставления государственных услуг, в том числе документов, получаемых с использованием межведомственного информационного взаимодействия.
3.2.2. Обращения за предоставлением услуг, не включенных в утвержденный Правительством Москвы перечень услуг, которые являются необходимыми и обязательными для предоставления государственных услуг.
3.2.3. Внесения платы за предоставление государственной услуги, не предусмотренной нормативными правовыми актами Российской Федерации и города Москвы.
3.2.4. Документов или информации, отсутствие и (или) недостоверность которых не указывались при первоначальном отказе в приеме документов, необходимых для предоставления государственной услуги, либо в предоставлении государственной услуги, за исключением случаев, предусмотренных пунктом 4 части 1 статьи 7 Федерального закона от 27 июля 2010 г. № 210-ФЗ «Об организации предоставления государственных и муниципальных услуг.
3.3. Нарушения срока предоставления государственной услуги.
3.4. Отказа заявителю:
3.4.1. В приеме документов, представление которых предусмотрено нормативными правовыми актами Российской Федерации и города Москвы для предоставления государственной услуги, по основаниям, не предусмотренным нормативными правовыми актами Российской Федерации и города Москвы.
3.4.2. В предоставлении государственной услуги по основаниям, не предусмотренным нормативными правовыми актами Российской Федерации и города Москвы.
3.4.3. В исправлении допущенных опечаток и ошибок в выданных в результате предоставления государственной услуги документах либо в случае нарушения установленного срока таких исправлений.
3.5. Иных нарушений порядка предоставления государственной услуги, установленного нормативными правовыми актами Российской Федерации и города Москвы.
4. Жалобы на решения и (или) действия (бездействие) должностных лиц, государственных гражданских служащих города Москвы, проходящих государственную гражданскую службу города Москвы в Департаменте, рассматриваются руководителем, уполномоченным заместителем руководителя указанного органа исполнительной власти города Москвы.
Жалобы на решения руководителя Департамента, в том числе на решения, принятые им или его заместителем по поступившим в досудебном (внесудебном) порядке жалобам, направляются в Правительство Москвы и рассматриваются Главным контрольным управлением города Москвы.
5. Жалобы могут быть поданы в органы исполнительной власти города Москвы, уполномоченные на их рассмотрение в соответствии с настоящим Регламентом (далее — органы, уполномоченные на рассмотрение жалоб), в письменной форме на бумажном носителе, в электронной форме одним из следующих способов:
5. 1. При личном обращении заявителя (представителя заявителя).
1. При личном обращении заявителя (представителя заявителя).
5.2. Почтовым отправлением.
5.3. С использованием Портала (при наличии технической возможности).
5.4. С использованием официальных сайтов органов, уполномоченных на рассмотрение жалоб, в информационно-телекоммуникационной сети Интернет.
6. Жалоба должна содержать:
6.1. Наименование уполномоченного на рассмотрение жалобы органа либо должность и (или) фамилию, имя и отчество (при наличии) соответствующего должностного лица, которому направляется жалоба.
6.2. Наименование органа исполнительной власти города Москвы либо должность и (или) фамилию, имя, отчество (при наличии) должностного лица, государственного служащего города Москвы, решения и (или) действия (бездействие) которых обжалуются.
6.3. Фамилию, имя, отчество (при наличии), сведения о месте жительства заявителя — физического лица, в том числе зарегистрированного в качестве индивидуального предпринимателя, либо наименование, сведения о месте нахождения заявителя — юридического лица, а также номер (номера) контактного телефона, адрес (адреса) электронной почты (при наличии) и почтовый адрес, по которым должен быть направлен ответ заявителю.
6.4. Дату подачи и регистрационный номер запроса на предоставление государственной услуги (за исключением случаев обжалования уклонения в приеме запроса на предоставление государственной услуги и его регистрации).
6.5. Сведения о решениях и (или) действиях (бездействии), являющихся предметом обжалования.
6.6. Доводы, на основании которых заявитель не согласен с обжалуемыми решениями и (или) действиями (бездействием). Заявителем могут быть представлены документы (при наличии), подтверждающие доводы заявителя, либо их копии.
6.7. Требования заявителя.
6.8. Перечень прилагаемых к жалобе документов (при наличии).
6.9. Дату составления жалобы.
7. Жалоба должна быть подписана заявителем (его представителем). В случае подачи жалобы при личном обращении заявитель (представитель заявителя) должен представить документ, удостоверяющий личность.
Полномочия представителя на подписание жалобы должны быть подтверждены доверенностью, оформленной в соответствии с законодательством Российской Федерации.
Полномочия лица, действующего от имени организации без доверенности на основании закона, иных нормативных правовых актов и учредительных документов, подтверждаются документами, удостоверяющими его служебное положение, а также учредительными документами организации.
Статус и полномочия законных представителей физического лица подтверждаются документами, предусмотренными федеральными законами.
8. Поступившая жалоба подлежит регистрации в срок не позднее рабочего дня, следующего за днем поступления.
9. Максимальный срок рассмотрения жалобы составляет 15 рабочих дней со дня ее регистрации. Срок рассмотрения жалобы составляет 5 рабочих дней со дня ее регистрации в случаях обжалования заявителем:
9.1. Уклонения в приеме документов.
9.2. Отказа в исправлении опечаток и ошибок, допущенных в документах, выданных в результате предоставления государственной услуги.
9.3. Нарушения срока исправлений опечаток и ошибок.
10. По результатам рассмотрения жалобы принимается решение об удовлетворении жалобы (полностью или в части) либо об отказе в удовлетворении жалобы.
11. Решение должно содержать:
11.1. Наименование органа, рассмотревшего жалобу, должность, фамилию, имя, отчество (при наличии) должностного лица, принявшего решение по жалобе.
11.2. Реквизиты решения (номер, дату, место принятия).
11.3. Фамилию, имя, отчество (при наличии), сведения о месте жительства заявителя — физического лица либо наименование, сведения о месте нахождения заявителя — юридического лица.
11.4. Фамилию, имя, отчество (при наличии), сведения о месте жительства представителя заявителя, подавшего жалобу от имени заявителя.
11.5. Способ подачи и дату регистрации жалобы, ее регистрационный номер.
11.6. Предмет жалобы (сведения об обжалуемых решениях, действиях, бездействии).
11.7. Установленные при рассмотрении жалобы обстоятельства и доказательства, их подтверждающие.
11.8. Правовые основания для принятия решения по жалобе со ссылкой на подлежащие применению нормативные правовые акты Российской Федерации и города Москвы.
11.9. Принятое по жалобе решение (вывод об удовлетворении жалобы или об отказе в ее удовлетворении).
11.10. Меры по устранению выявленных нарушений и сроки их выполнения (в случае удовлетворения жалобы).
11.10(1). Информацию о действиях, осуществляемых органом исполнительной власти города Москвы, предоставляющим государственную услугу, в целях незамедлительного устранения выявленных нарушений при оказании государственной услуги, а также извинения за доставленные неудобства и информацию о дальнейших действиях, которые необходимо совершить заявителю в целях получения государственной услуги (в случае удовлетворения жалобы).
11.10(2). Аргументированные разъяснения о причинах принятого решения (в случае отказа в удовлетворении жалобы).
11.11. Порядок обжалования решения.
11.12. Подпись уполномоченного должностного лица.
12. Решение оформляется в письменном виде с использованием официальных бланков.
13. К числу указываемых в решении мер по устранению выявленных нарушений в том числе относятся:
13. 1. Отмена ранее принятых решений (полностью или в части).
1. Отмена ранее принятых решений (полностью или в части).
13.2. Обеспечение приема и регистрации запроса на предоставление государственной услуги, оформления и выдачи заявителю расписки (при уклонении в приеме документов и их регистрации).
13.3. Обеспечение оформления и выдачи заявителю результата предоставления государственной услуги (при уклонении или необоснованном отказе в предоставлении государственной услуги).
13.4. Исправление опечаток и ошибок, допущенных в документах, выданных в результате предоставления государственной услуги.
13.5. Возврат заявителю денежных средств, взимание которых не предусмотрено нормативными правовыми актами Российской Федерации и города Москвы.
14. Орган, уполномоченный на рассмотрение жалобы, отказывает в ее удовлетворении в случаях:
14.1. Признания обжалуемых решений и (или) действий (бездействия) законными, не нарушающими прав и свобод заявителя.
14.2. Подачи жалобы лицом, полномочия которого не подтверждены в порядке, установленном нормативными правовыми актами Российской Федерации и города Москвы.
14.3. Отсутствия у заявителя права на получение государственной услуги.
14.4. Наличия:
14.4.1. Вступившего в законную силу решения суда по жалобе заявителя с тождественными предметом и основаниями.
14.4.2. Решения по жалобе, принятого ранее в досудебном (внесудебном) порядке в отношении того же заявителя и по тому же предмету жалобы (за исключением случаев обжалования ранее принятых решений в вышестоящий орган).
15. Жалоба подлежит оставлению без ответа по существу в случаях:
15.1. Наличия в жалобе нецензурных либо оскорбительных выражений, угроз жизни, здоровью и имуществу должностных лиц, а также членов их семей.
15.2. Если текст жалобы (его часть), фамилия, почтовый адрес и адрес электронной почты не поддаются прочтению.
15.3. Если в жалобе не указаны фамилия заявителя (представителя заявителя) или почтовый адрес и адрес электронной почты, по которым должен быть направлен ответ.
15.4. Если в орган, уполномоченный на рассмотрение жалобы, поступило ходатайство заявителя (представителя заявителя) об отзыве жалобы до вынесения решения по жалобе.
16. Решение об удовлетворении жалобы или об отказе в удовлетворении жалобы направляется заявителю (представителю заявителя) в срок не позднее окончания рабочего дня, следующего за днем его принятия, по почтовому адресу, указанному в жалобе. По желанию заявителя решение также направляется на указанный в жалобе адрес электронной почты (в форме электронного документа, подписанного электронной подписью уполномоченного должностного лица). В таком же порядке заявителю (представителю заявителя) направляется решение по жалобе, в которой для ответа указан только адрес электронной почты, а почтовый адрес отсутствует или не поддается прочтению.
17. В случае оставления жалобы без ответа по существу заявителю (его представителю) направляется в срок не позднее окончания рабочего дня, следующего за днем регистрации жалобы, письменное мотивированное уведомление с указанием оснований (за исключением случаев, когда в жалобе не указаны почтовый адрес и адрес электронной почты для ответа или они не поддаются прочтению). Уведомление направляется в порядке, установленном для направления решения по жалобе.
Уведомление направляется в порядке, установленном для направления решения по жалобе.
18. Жалоба, поданная с нарушением правил о компетенции, установленных пунктом 5.4 настоящего Регламента, направляется в срок не позднее окончания рабочего дня, следующего за днем ее регистрации, в орган, уполномоченный на рассмотрение жалобы, с одновременным письменным уведомлением заявителя (его представителя) о переадресации жалобы (за исключением случаев, когда в жалобе не указаны почтовый адрес и адрес электронной почты для ответа или они не поддаются прочтению). Уведомление направляется в порядке, установленном для направления решения по жалобе.
19. Подача жалобы в досудебном (внесудебном) порядке не исключает права заявителя (представителя заявителя) на одновременную или последующую подачу жалобы в суд.
20. Информирование заявителей о судебном и досудебном (внесудебном) порядке обжалования решений и (или) действий (бездействия), совершенных при предоставлении государственной услуги, должно осуществляться путем:
20. 1. Размещения соответствующей информации на информационных стендах в местах предоставления государственной услуги.
1. Размещения соответствующей информации на информационных стендах в местах предоставления государственной услуги.
20.2. Консультирования заявителей, в том числе по телефону, электронной почте, при личном приеме.
21. В случае установления в ходе или по результатам рассмотрения жалобы признаков состава административного правонарушения или преступления должностное лицо, наделенное полномочиями по рассмотрению жалобы, незамедлительно направляет имеющиеся материалы в органы прокуратуры.
При выявлении нарушений порядка предоставления государственных услуг города Москвы, ответственность за совершение которых установлена Кодексом города Москвы об административных правонарушениях, должностное лицо, наделенное полномочиями по рассмотрению жалобы, также должно направить копии имеющихся материалов в Главное контрольное управление города Москвы в течение двух рабочих дней, следующих за днем вынесения решения по жалобе (но в срок не позднее рабочего дня, следующего за днем истечения установленного федеральным законодательством срока рассмотрения жалоб на нарушения порядка предоставления государственных услуг).
Лицензирование фармацевтической деятельности (лицензия на фармацевтическую деятельность)
Республика Казахстан принимает ряд мер для обеспечения населения Республики Казахстан качественными лекарственными средствами и изделиями медицинского назначения. Одной из важнейших мер в этой сфере является лицензирование фармацевтической деятельности.
В соответствии с кодексом РК «О здоровье народа и системе здравоохранения» под фармацевтической деятельностью понимается деятельность (
лицензия на фармацевтическую деятельность), осуществляемая в области здравоохранения по производству, изготовлению (за исключением медицинской техники), оптовой и розничной реализации лекарственных средств, изделий медицинского назначения и медицинской техники, связанная с закупом (приобретением), хранением, ввозом, вывозом, контролем качества, оформлением, распределением, использованием и уничтожением лекарственных средств, изделий медицинского назначения и медицинской техники, а также обеспечением их безопасности, эффективности и качества.
В настоящее время в соответствии с Законом Республики Казахстан «О лицензировании» от 11.01.2007 года, лицензированию подлежат следующие подвиды фармацевтической деятельности:
- производство лекарственных средств;
- производство изделий медицинского назначения;
- производство медицинской техники;
- изготовление лекарственных препаратов;
- изготовление изделий медицинского назначения;
- оптовая реализация лекарственных средств;
- оптовая реализация изделий медицинского назначения;
- оптовая реализация медицинской техники;
- розничная реализация лекарственных средств;
- розничная реализация изделий медицинского назначения;
- розничная реализация медицинской техники.
Квалификационные требования, предъявляемые к субъектам, осуществляющим деятельность в сфере здравоохранения, утверждены Постановлением Правительства №2301 от 30.12.2009 года.
Для сбора документов и определения подвида деятельности в сфере обращения лекарственных средств, медицинской техники и изделий медицинского назначения необходимо в первую очередь ознакомиться с правилами реализации указанной продукции.
Реализация лекарственных средств, изделий медицинского назначения, медицинской техники.
Кодекс «О здоровье народа и системе здравоохранения» определяет, что оптовая и розничная реализация лекарственных средств, изделий медицинского назначения, медицинской техники производится в порядке, определяемом Правительством Республики Казахстан.
В соответствии с действующим законодательством Республики Казахстан в области фармацевтической деятельности оптовая реализация лекарственных средств, изделий медицинского назначения, медицинской техники производится в аптечных складах, складах изделий медицинского назначения и медицинской техники. Розничная реализация лекарственных средств, изделий медицинского назначения и медицинской техники осуществляется субъектами в сфере обращения лекарственных средств, изделий медицинского назначения и медицинской техники в аптеках, аптечных пунктах, передвижных аптечных пунктах, магазинах оптики, магазинах медицинской техники и изделий медицинского назначения.
Изменения в лицензировании фармацевтической деятельности (лицензия на фармацевтическую деятельность)
15 июля 2011 года был принят Закон Республики Казахстан «О внесении изменений и дополнений в некоторые законодательные акты Республики Казахстан по вопросам совершенствования разрешительной системы» (далее Закон), который вступил в силу 30.01.2012 года. Изменения коснулись также и фармацевтической деятельности. В частности конкретизированы квалификационные требования, предъявляемые к лицам, желающим осуществлять деятельность по реализации лекарственных средств через передвижной аптечный пункт для отдаленных сельских местностей, где отсутствуют аптеки.
Подготовлено Старшим юристом
«ZAN» Юридической Компании Астамбаевой Гульзифой
Ваш комментарий
Природоохранная прокуратура разъясняет порядок лицензирования в сфере торговли лекарственными средствами для ветеринарного применения
В соответствии с пунктом 33 статьи 4 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (далее – Закон) фармацевтической деятельностью является деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов.
Согласно пункту 47 части 1 статьи 12 Федерального закона от 04.05.2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» фармацевтическая деятельность подлежит лицензированию.
Таким образом, для розничной продажи лекарственных препаратов для ветеринарного применения необходима лицензия на осуществление фармацевтической деятельности в сфере обращения лекарственных препаратов для ветеринарного применения.
Порядок лицензирования фармацевтической деятельности, а также перечень лицензионных требований, которым должен соответствовать соискатель лицензии /лицензиат для осуществления фармацевтической деятельности, определены Положением о лицензировании фармацевтической деятельности, утвержденным постановлением Правительства Российской Федерации от 22.12.2011 № 1081.
Исчерпывающий перечень документов для предоставления лицензии на фармацевтическую деятельность, подлежащих представлению заявителем, установлен пунктом 13 Административного регламента по предоставлению Россельхознадзором государственной услуги по лицензированию фармацевтической деятельности, осуществляемой в сфере обращения лекарственных средств для ветеринарного применения, утвержденного приказом Россельхознадзора от 28.12.2020 № 1406.
Кроме того, в силу части 1 статьи 13 Закона в Российской Федерации допускаются производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных препаратов для ветеринарного применения, если они зарегистрированы Россельхознадзором и внесены в государственный реестр лекарственных средств для ветеринарного применения. Указанный реестр размещен в свободном доступе на официальном сайте Россельхознадзора.
Таким образом, на территории Российской Федерации допустима розничная торговля только лекарственными препаратами для ветеринарного применения, включенными в реестр лекарственных средств для ветеринарного применения, при наличии полученной в установленном порядке лицензии на осуществление фармацевтической деятельности.
Осуществление указанной деятельности без лицензии влечёт административную ответственность по ст. 14.1 КоАП РФ.
Лицензирование перевозки лекарственных средств | Юнико-94
В соответствии с пунктом 2 утвержденного Постановлением Правительства РФ от 22.12.2011 г. N 1081 «Положения о лицензировании фармацевтической деятельности» (в ред. от 04.07.2017) фармацевтическая деятельность включает следующие виды работ и услуг:1. В сфере обращения лекарственных средств для медицинского применения:
1.1 Оптовая торговля лекарственными средствами для медицинского применения;
1.2. Хранение лекарственных средств для медицинского применения;
1.3. Хранение лекарственных препаратов для медицинского применения;
1.4. Перевозка лекарственных средств для медицинского применения;
1.5. Перевозка лекарственных препаратов для медицинского применения;
1.6. Розничная торговля лекарственными препаратами для медицинского применения;
1.7. Отпуск лекарственных препаратов для медицинского применения;
1.8. Изготовление лекарственных препаратов для медицинского применения.
2. В сфере обращения лекарственных средств для ветеринарного применения:
1. Оптовая торговля лекарственными средствами для ветеринарного применения;
2. Хранение лекарственных средств для ветеринарного применения;
3. Хранение лекарственных препаратов для ветеринарного применения;
4. Перевозка лекарственных средств для ветеринарного применения;
5. Перевозка лекарственных препаратов для ветеринарного применения;
6. Розничная торговля лекарственными препаратами для ветеринарного применения;
7. Отпуск лекарственных препаратов для ветеринарного применения;
8. Изготовление лекарственных препаратов для ветеринарного применения.
Как можно видеть из приведенного выше перечня каждый вид работ (услуг) указан в нем отдельно без ссылки на какой-либо другой вид работ (услуг), в совокупности с которым он должен осуществляться.
В то же время установленные пунктами 4 и 5 Положения о лицензировании лицензионные требования не устанавливают к соискателю лицензии или лицензиату отдельного требования к осуществлению такого вида услуг как «перевозка лекарственных средств (препаратов)».
Отметим также, что согласно пункту 33 статьи 4 Федерального закона РФ от 12.04.2010 г. N 61-ФЗ «Об обращении лекарственных средств» (в ред. от 03.07.2016) фармацевтической деятельностью, которая подлежит лицензированию, является деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов. Таким образом, в установленном Законом определении фармацевтической деятельности такой вид работ (услуг) как перевозка лекарственных препаратов упоминается исключительно в совокупности с оптовой или розничной торговлей лекарственными средствами.
Из изложенного можно сделать вывод о том, что с формальной точки зрения лицензирование одного только вида работ (услуг) действующим законодательством в явном виде не запрещено, однако в силу нечеткости формулировок нормативно-правовых актов такая трактовка может быть признана сомнительной, особенно с учетом того, что в Положении о лицензировании отсутствуют отдельно выделенные лицензионные требования к осуществлению перевозки лекарственных средств.
Следует также обратить внимание, что согласно пункту 2 утвержденного Приказом Минздрава РФ от 7.07.2015 г. N 419н «Административного регламента по предоставлению органами исполнительной власти субъектов российской федерации государственной услуги по лицензированию фармацевтической деятельности (за исключением деятельности, осуществляемой организациями оптовой торговли лекарственными средствами для медицинского применения и аптечными организациями, подведомственными федеральным органам исполнительной власти, государственным академиям наук)» перечисленные в Приложении к «Положению о лицензировании фармацевтической деятельности» работы (услуги) выполняются (оказываются) в составе фармацевтической деятельности, из чего можно заключить, что отдельно указанные услуги не оказываются.
Таким образом, нам представляется, что при подаче в лицензирующий орган индивидуальным предпринимателем заявление на получение лицензии только на перевозку лекарственных средств, ему с высокой степенью вероятности в приеме заявления будет отказано.
Что касается лицензионных требований, предъявляемых к индивидуальному предпринимателю для осуществления фармацевтической деятельности, то они прямо перечислены в указанном выше Положении о лицензировании. В частности, индивидуальный предприниматель должен иметь:
— высшее фармацевтическое образование и стаж работы по специальности не менее 3 лет или среднее фармацевтическое образование и стаж работы по специальности не менее 5 лет, а также сертификат специалиста;
— работников, заключивших с ним трудовые договоры, деятельность которых непосредственно связана с оптовой торговлей лекарственными средствами, их хранением и (или) розничной торговлей лекарственными препаратами, их отпуском, хранением и изготовлением, имеющих высшее или среднее фармацевтическое образование и сертификат специалиста. Автор ответа:
Директор юридической компании «Юнико-94»
М. И. Милушин
Сертификатов на фармацевтическую продукцию: Общая информация
Иностранные заказчики или иностранные правительства часто просят предприятия, экспортирующие лекарства для людей, предоставить документацию о соответствии предприятия стандартам FDA. FDA выдает экспортные сертификаты на одобренные или лицензированные лекарственные препараты, а также на неутвержденные лекарственные препараты, которые соответствуют определенным требованиям законодательства.
Сертификаты фармацевтического продукта (CPP) выдаются для лекарств для людей, экспортируемых из США непосредственно в запрашивающую страну. CPP соответствуют формату, установленному Всемирной организацией здравоохранения (ВОЗ), и предназначены для использования странами-импортерами при рассмотрении вопроса о лицензировании данного продукта для продажи в этой стране. Срок действия сертификатов истекает через 24 месяца с даты выдачи, после которой необходимо подать новое заявление. Сертификаты не подлежат перевыпуску.
FDA опубликовало ресурсы, которые позволяют заинтересованным сторонам проверять, одобрено ли лекарство или биологический препарат FDA, и просматривать классификацию FDA инспекций зарубежных предприятий:
- Оранжевая книга FDA, общедоступная база данных с информацией об одобренных FDA лекарствах, такой как дата утверждения
- База данных инспекционной классификации FDA, где заинтересованные стороны могут найти самую последнюю инспекционную классификацию предприятия.
- Письма FDA, которые направляются предприятию в течение 90 дней с момента проверки и указывают на классификацию предприятия при проверке агентством
CPP напечатаны на защищенной бумаге и содержат подпись уполномоченного представителя FDA, тисненую федеральную печать и ленту.
FDA имеет право взимать плату за CPP, выпущенные в течение 20 дней с момента получения заявки, но не более 175 долларов США. Комиссия:
- Первый сертификат для той же страны в том же приложении ….. $ 175,00
- Второй сертификат для той же страны в том же приложении ….. 90,00
- Третий и последующие сертификаты для той же страны в одном приложении ….. 40,00
Просьба не отправлять оплату вместе с заявкой; счета выставляются ежеквартально.Заявки CPP могут быть поданы с использованием онлайн-портала системы экспортной сертификации и отслеживания CDER (CDEReCATS).
По вопросам о CPP обращайтесь по электронной почте [email protected] или по телефону 301-796-4950.
Текущее содержание с:
Регулируемые продукты
Тема (и)
Часто задаваемые вопросы, Аптечный совет, Профессиональное лицензирование, Отдел корпораций, Бизнес и профессиональное лицензирование
Часто задаваемые вопросы о новом типе лицензии
Чтобы найти ответы на общие вопросы, касающиеся аутсорсинга, сторонних поставщиков логистических услуг (3PL) и оптовые дистрибьюторы лекарств-нерезидентов, пожалуйста, просмотрите это Документ с часто задаваемыми вопросами о новых типах лицензий.
Часто задаваемые вопросы (FAQ)
Каковы требования к изменению имени, физического местонахождения, владельца, ответственного фармацевта или руководителя учреждения? (Этот вопрос относится только к аптекам, оптовым дистрибьюторам лекарств, аутсорсинговым предприятиям и сторонним поставщикам логистических услуг).Для аптек требуется новое отдельное приложение в случае изменения имени администратора базы данных, владельца (родительский / прямой) или физического местонахождения. Новое заявление не требуется для смены ответственного фармацевта; однако уведомление об этом изменении необходимо в течение 10 дней с помощью формы № 08-4064.
Для оптовых дистрибьюторов лекарств, в отношении которых происходит изменение физического местонахождения, владельца или руководителя учреждения, новый руководитель учреждения должен подать уведомление об изменении менеджера, используя форму № 08-4064. Менеджер предприятия также должен предоставить заполненную карточку с отпечатками пальцев и резюме всех должностных лиц, директоров или основных заинтересованных сторон. Их необходимо отправить в течение 30 дней с момента внесения изменений.
Для аутсорсинговых предприятий и сторонних поставщиков логистических услуг, при изменении названия, физического местонахождения, владельца или управляющего объектом, требуется новое отдельное приложение.Если изменение включает смену руководителя объекта, входящее и текущее уведомление об этом изменении должно сопровождать заявку, используя формы № 08-4064 и № 08-4285. Уведомление о смене руководителя объекта необходимо подать в течение 10 дней.
Как смена имени, физического местонахождения, владельца, ответственного фармацевта или руководителя учреждения влияет на нашу возможность продления?Если не указаны временные рамки (например, 30 дней для смены оптового поставщика лекарств), лицензия или регистрация не подлежат продлению.Если срок указан, он может быть продлен. Вот приемлемый сценарий: для оптового дистрибьютора лекарств, который изменил свое местонахождение 15 декабря и подал заявку на продление 31 декабря, существующая лицензия может быть продлена 1 января, даже если адрес больше не верен, потому что нормативные акты позволяют 30 дней, в данном примере до 14 января, чтобы подать уведомление об изменении документов.
Могут ли аптечные техники работать удаленно из дома с фармацевтом, который физически присутствует в аптеке?№Техник в аптеке должен работать под непосредственным наблюдением фармацевта в соответствии с 12 AAC 52.230. «Прямой надзор» определен в 12 AAC 52.995 (a) (13) и применяется только в контексте системы телефонной аптеки для категории лицензии удаленной аптеки.
Нужна ли водителям, занимающимся доставкой из аптек, лицензия фармацевта для доставки рецептов пациентам?До тех пор, пока единственной целью и намерением лица, используемого для выдачи рецептов, является доставка рецептов пациенту, им не нужна лицензия фармацевта.
Регулирует ли правление тестирование в местах оказания медицинской помощи и / или предоставляет ли он отказ от CLIA?Нет, правление не регулирует тестирование в местах оказания медицинской помощи, поскольку оно обнародовано Департаментом здравоохранения и социального обеспечения Аляски (DHSS) в рамках программы внесения поправок в клиническую лабораторию (CLIA). Для получения дополнительной информации посетите веб-сайт Отдела общественного здравоохранения DHSS.
Где я могу найти ссылку на список всех одобренных в настоящее время взаимозаменяемых биологических продуктов Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA)? Сторонний поставщик логистических услуг для продажи или транспортировки безрецептурных лекарств требуется лицензия?Нет, правление не имеет полномочий регулировать продажу внебиржевых продуктов, как это явно предусмотрено в AS. 08.80.045. Правление имеет право требовать лицензию только для сторонних поставщиков логистических услуг, занимающихся транспортировкой. рецептурные препараты в соответствии с AS 08.80.159, поэтому, если перевозимые продукты включают только безрецептурные продукты, лицензия не требуется.
Обратный дистрибьютор получает контролируемые вещества для целей возврата веществ или обработки веществ для утилизации на от имени другого лица, зарегистрированного DEA, необходимого для получения лицензии?Нет, плата не требует, чтобы обратный дистрибьютор получил лицензию на Аляске, если предприятие не продажа или намерение продать вещества.
Плата требует контролируемого вещества, которые должны быть написаны на защищенных от взлома блокнотах с рецептами?Хотя плата не соответствует этому требованию в соответствии с AS 08.80 или 12 AAC 52, Центры для Услуги Medicare и Medicaid (CMS), в которых выписанные рецепты должны быть на защищенных от взлома блокнотах со сценариями. Аптеки следует следовать Закон о рецептах защиты от несанкционированного доступа Medicaid, который гласит, что со 2 апреля 2008 г. рецепт должен содержать по крайней мере одну из следующих мер, чтобы считаться устойчивым к несанкционированному доступу: особенность предназначены для предотвращения несанкционированного копирования заполненной или пустой формы рецепта; функции, предназначенные для предотвращения изменение или удаление информации, записанной в блокноте с рецептами; или функции, предназначенные для предотвращения использование поддельных рецептов.Если вы сомневаетесь в законности рецепта, сообщите об этом практикующий врач, выписывающий рецепты.
Доска разрешает выдачу киосков?Во время заседания совета директоров 15 ноября 2019 года совет директоров рассмотрел 12 AAC 52.240, который требует, чтобы лекарства и устройства хранится в рецептурном отделении. Согласно этому постановлению, совет директоров высказал мнение, что автоматическое дозирование шкафы / киоски не будут разрешены.
Может ли техник аптеки участвовать в отправка и получение заказа на отпускаемые по рецепту лекарственные препараты, не являющиеся контролируемыми, в соответствии с 12 AAC 52.500?На заседании правления 15 ноября 2019 г. правление проголосовало за предложение нового раздела для сертифицированных на национальном уровне технический персонал, в том числе возможность для них участвовать в передаче рецептов на неконтролируемые вещества между двумя аптеками по 12 AAC 52.500.
Какие требования к самостоятельному вводить вакцины и соответствующие лекарства неотложной помощи, и кто уполномочен это делать? Продолжаются ли требования к образованию, связанные с этим?Фармацевты и стажеры в аптеке могут независимо проводить иммунизацию, инъекцию адреналина или другое лекарства для лечения тяжелой аллергической реакции только после прохождения необходимого обучения, аккредитованного Советом по аккредитации фармацевтического образования (ACPE) и завершения сердечно-легочной реанимации (CPR) и обучение автоматическому внешнему дефибриллятору (AED).Полный список требований можно найти в разделе AS 08.80.168, 12 AAC 52.992 и 7 AAC 27.650 при Министерстве здравоохранения и социальных служб (см. документ VacTrAK здесь). Самостоятельное проведение иммунизации или сопутствующие лекарства неотложной помощи не требует предварительного одобрения совета директоров. Совет также не требует, чтобы фармацевты или стажеры в аптеке представляли в документацию нашего отдела об успешном завершении этих курсов; однако фармацевты, контролирующие стажер, планирующий проводить иммунизацию или принимать соответствующие неотложные лекарства, должен использовать причитающиеся им усердие, чтобы гарантировать, что стажер аптеки выполнил требования к обучению.Только стажеры в аптеке, чьи контролирующие фармацевты прописывают иммунизацию или соответствующие лекарства для неотложной помощи и иным образом соблюдают 12 AAC 52.992 может участвовать в этой деятельности.
Лицензиаты, желающие участвовать в непрерывном проведении иммунизации и связанных с ними лекарств неотложной помощи должен пройти один час непрерывного образования в соответствии с 12 AAC 52.320 (e)
Где я могу найти приложения, формы и Инструкции?Заявки на первоначальную лицензию, продление лицензии, восстановление истекшей лицензии, совместная практика, Смена PIC / менеджера аптеки и самостоятельные проверки доступны через наш Заявления и формы страница в Интернете.
Формы для смены имени, смены адреса, подтверждения лицензии, дублирования запроса на лицензию, кредитной карты Платежи и освобождение от требований SSN находятся в разделе «Важные ссылки» на Домашняя страница профессионального лицензирования.
Как я могу узнать о статусе моего заявление?Если ваша заявка не заполнена, вы получите уведомление по почте или электронной почте, как только ваша заявка будет рассмотрена. Пожалуйста, подождите от трех до четырех недель с даты получения заявления, прежде чем ваше статусное письмо будет доставлено вам.
Как в аптеке и / или фармацевтам предоставлять своим пациентам антикоагулянты.Это достигается с помощью одобренного советом совета директоров. См. «Формы и инструкции» выше.
Как мне получить «Заверенную точную копию» документ?Для получения заверенной подлинной копии отнесите оригинал документа и ксерокопию нотариусу, чтобы он / она сравните оригинал с фотокопией документа. Либо заявитель, либо нотариус должны написать: «Я подтверждаю это должна быть точная копия оригинального документа »на фотокопии и подтвердить этот факт, подписав документ и нотариально заверенный.
На нашем объекте будет Смена Местоположение, смена имени, смена владельца. Что мы должны делать?Во всех этих случаях предприятию необходимо приобрести новую лицензию и новый номер лицензии. Это делается заполнение соответствующего заявления.
Что мне делать, если у меня есть убеждение, но все же хотите подать заявку на лицензию?Внимательно прочтите инструкцию в этом разделе приложения. Вам будет предложено отправить письмо самообъяснение и копия юридических / судебных / коллегиальных документов, касающихся обвинительного приговора.Когда ваше приложение заполнено, оно будет отправлено на рассмотрение в отдел расследований. Затем он будет рассмотрен кворумом Правления Члены аптеки, которые примут окончательное решение о лицензировании.
Где я могу найти информацию о дозировании орган власти? Каковы лицензионные требования для Продавцы медицинского оборудования длительного пользования?Все поставщики DME должны иметь бизнес-лицензию на Аляске. Если вы также отправляете рецептурные лекарства напрямую в Жители Аляски (vs.доставка на объект), вы также должны иметь лицензию Аптечного совета.
Могу ли я отправить приложение по факсу или сканированию документ?Нет. Документы, заверенные нотариусом или скрепленные печатью, не могут быть отправлены по факсу или отсканированы. Подать документы через Почтовое отправление.
Как мне скачать список лицензиатов с ваша база данных?- Перейти на домашнюю страницу корпоративных, коммерческих и профессиональных лицензий.
- Выберите поле «Профессиональное лицензирование».
- В разделе «Важные ссылки» выберите «Загрузить список владельцев лицензий «.
- В раскрывающемся списке профессий выберите «Аптека» и нажмите «Продолжить».
- Сделайте нужный выбор на шагах 2 и 3
- Введите адрес электронной почты для отправки информации на шаге 4 И выберите «Получить счетчик» и отправьте данные по электронной почте ИЛИ Дайте мне граф
Ответы на наиболее часто задаваемые вопросы для тех, кто подает заявку на лицензию фармацевта на Аляске, дан в Руководстве по получению лицензии на Аляску. Лицензия фармацевта .Сначала обратитесь к этому, а затем свяжитесь с Аптечным советом для получения дополнительной информации. вопросов.
Как я могу получить профессиональную лицензию Поиск?Щелкните оранжевую кнопку вверху этой страницы. Обратите внимание, что аббревиатура «доска» — PHA. Вы должны открыть Click Здесь диалоговое окно, если вы будете вводить тип лицензии, чтобы найти правильную аббревиатуру.
Является ли моя лицензионная деятельность общедоступной?Да, лицензионные записи являются общедоступными документами и доступны для общественности по письменному запросу и оплата копировальных сборов.Информация, которая считается конфиденциальной и не подлежит разглашению, включает: номера социального страхования и другая информация, считающаяся конфиденциальной согласно законам штата или федеральному закону. Ваш адрес запись является общедоступной и отображается в онлайн- Поиск лицензий. Лицензиаты выразили обеспокоенность тем, что их адрес так легко доступен. Некоторые лицензиаты предпочли почтовый ящик или место практики для их официального адреса записи, чтобы избежать их проживания адрес легко доступен.Обратите внимание, что все уведомления от Правления (уведомления о продлении, лицензии и другие юридические документы) будут отправлены по указанному адресу.
Могу ли я получить временную лицензию?Свяжитесь с экспертом по лицензированию аптек относительно требований временного разрешения или прочтите 12 AAC 52.100 в Книга Положений и Положений об аптеках.
У врача, выписавшего рецепт в моем районе, недавно было его / ее лицензия на занятие практикой приостановлена / аннулирована или умерла. Могу ли я получить рецепт, выписанный им / ею? Какие насчет заправки?Ответ на Аляске довольно прост.Закон обычно требует, чтобы рецепт был действительным, он должен быть написано должным образом лицензированным врачом, выписавшим рецепт, написанным в ходе обычной обычной практики, для действительного пациенту, выписавшему рецепт, и по уважительной медицинской причине. Таким образом, до тех пор, пока лицензия врача, выписывающего рецепт был действителен, когда рецепт был выписан для его / ее пациента (у которого был фактический поставщик-пациент отношения), рецепт был выписан в соответствии с обычной практикой и предназначен для законного медицинского причина, то рецепт может быть заполнен.Тот же анализ применим и к заправкам. Для краткого примера, Dr. Джонс выписывает рецепт для своего пациента, мистера Смита, 6 апреля 2016 года с тремя добавками. На следующий день, 7 апреля доктор Джонс сдает лицензию и сдает регистрацию в DEA. Если г-н Смит представит рецепт и фармацевт считает, что это было написано обычным курсом и для законной медицинской цели, рецепт и доливки могут быть выполнены. То же самое, если выписывающий рецепт умер.
Требования к лицензии для физических лиц Фармацевты, работающие в программах охраны здоровья племен HB 159 Разъяснительное письмо от Стул Может ли аптека запросить удостоверение личности, когда получить рецепт на контрольное вещество?Да, хотя нет специального постановления штата Аляска, требующего предъявления удостоверения личности, руководство Управления по борьбе с наркотиками на федеральном уровне, согласно которому фармацевт может запросить правильная идентификация.
Хочу подать заявку переводом очков. В чем разница между передачей лицензии и передачей баллов, и как заставить NABP отправить копию моего Результаты экзамена NAPLEX Фармацевтическим советом Аляски?Подача заявки на передачу лицензии отличается от процесса передачи баллов. Заявление о передаче лицензии в на самом деле применяется на основе взаимности в соответствии с AS 08.80.145 и требует, чтобы заявитель подал в NABP заявку на получение передача лицензии в Аптечный совет Аляски.Документ о передаче лицензии предоставлен Доска покажет, сдал ли кандидат NAPLEX и для какой юрисдикции был сдан экзамен. Этого будет достаточно для документирования результатов экзамена NAPLEX согласно требованиям 12 AAC 52.095. Оценка НАБП Программа перевода предназначена для поступающих на экзамен по 12 AAC 52.070 и позволяет фармацевту соискателям лицензии для организации передачи отчета об оценке NAPLEX из юрисдикции, в которой этот экзамен ранее и успешно сданы.Регулирование Фармацевтического совета Аляски позволяет переводить баллы до 12 AAC 52.090 (c), согласно которому кандидат должен согласовать с NABP перевод баллов NAPLEX на Аляску. Аптечный совет. Если вы выбираете этот вариант, укажите это в своем заявлении. Обратите внимание, что оценка вариант перевода доступен только для заявителей, которые приняли NAPLEX в течение 90 дней, поскольку NABP делает только доступны эти оценки за тот период времени. Если дата, в которую вы будете подавать заявку, имеет превысили этот 90-дневный срок, просьба не указывать этот вариант заявки.
Может ли ответственный фармацевт (ПОС) быть КВС для более чем одной аптеки?В настоящее время нет ограничений на количество аптек, за которые может отвечать отдельный PIC. Хотя это указано только для удаленных аптек в соответствии с 12 AAC 52.425, что PIC может быть PIC для более чем одного удаленного аптеки, аналогичный язык для аптек вообще не встречается. Фармацевты, которые предпочитают быть лично ответственный за более чем одну аптеку может делать это по своему усмотрению, но должен знать обо всех своих обязанности в соответствии с AS 08, 12 AAC 52 и применимым федеральным законодательством.Если вы будете входящим PIC в существующей лицензированной аптеке, обратите внимание, что вы должны отправить соответствующую форму № 08-4064 в течение 10 дней после назначение в качестве ПОС.
объектов | Государственный фармацевтический совет
Некоторые ссылки на этой странице ведут на веб-сайты, поддерживаемые другими государственными учреждениями или корпорациями. Аптечный совет Айдахо не несет ответственности за содержание этих сайтов.
Создать кредитный счетДля предприятий / предприятий, имеющих лицензию в Айдахо, которые никогда раньше не использовали систему электронного правительства My License.Вход для вернувшихся пользователей
Если ранее зарегистрировались в системе электронного правительства и создали имя пользователя и пароль.
Плата за подачу заявления не возвращается в соответствии с IDAPA 24.36.01.202.02. Кроме того, средства внутреннего контроля не подлежат передаче . Убедитесь, что вы отправляете правильную заявку и что нужно подать НОВУЮ заявку. Для продления не требуется подавать заявление. Если вы не уверены, позвоните в наш офис для уточнения.208-334-2356.
Государственные аптеки
Чтобы подать заявку на новую регистрацию / лицензию или продлить текущую регистрацию / лицензию, посетите наш онлайн-портал лицензирования
Требования к заявкам и необходимые документы
- Владельцы и партнеры — включая адреса, номера телефонов и процент владения
- Описание работы аптеки
- Федеральная регистрация DEA
- Копия регистрационного заявления DEA — должна содержать контрольный номер (например,W1234567C)
- ИЛИ копия запроса на изменение адреса
IDAPA 24.36.01.600 Контролируемые вещества: PDMP
Указанные данные о контролируемых веществах должны быть предоставлены к концу следующего рабочего дня всеми аптеками, которые распределяют контролируемые вещества в Айдахо или в Айдахо, и лицами, назначающими лекарства, которые отпускают контролируемые вещества людям.
Аптечный совет Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356
При изменении физического адреса для регистрации / лицензирования необходимо подать заявку на изменение адреса в Аптечный совет как минимум за за тридцать (30) дней до изменения.
Для смены владельца необходимо подать заявление о смене владельца в Аптечный совет как минимум за за тридцать (30) дней до изменения.
Чтобы подать заявление об изменении адреса или владельца:
- Получите перечисленные выше документы для новой регистрации / лицензии
- Войдите на наш онлайн-портал лицензирования, используя учетные данные для вашей текущей лицензии / регистрации
- Нажмите «Первоначальное приложение» и выберите «Смена адреса» или «Смена владельца». Получено методом после выбора «Аптека» и желаемого типа лицензии / регистрации.
- Следуйте инструкциям на экране, чтобы заполнить заявку.
Плата за заполнение данной формы не взимается
Политика совета директоровтребует подачи этого заявления в фармацевтический совет как минимум за за тридцать (30) дней за до предполагаемой даты изменения.
Инструкции по подаче заявки на изменение имени
- Заполните форму изменения названия объекта.
- Войдите, используя свои учетные данные на нашем онлайн-портале, и завершите процесс обновления лицензии для вашей лицензии / регистрации.
- Выберите «Обновление лицензии» в меню
- Выберите соответствующий объект Лицензия / регистрация
- Следуйте инструкциям, чтобы перейти на страницу «Прикрепить документы».
- Загрузите заполненную форму изменения имени
- Отправьте обновление лицензии.
- Отправьте письмо по адресу [email protected]. В теме письма следует указать название учреждения и номер лицензии / регистрации.
Важное примечание. При изменении названия объекта в результате смены владельца необходимо подать онлайн-заявку через учетную запись электронного правительства для существующего объекта, лицензированного в Айдахо. Затем необходимо загрузить форму изменения имени в приложение
для смены владельца.Вне государственных аптек
Чтобы подать заявку на новую регистрацию или продлить текущую регистрацию, посетите наш онлайн-портал лицензирования.Требования к заявкам и необходимые документы
- Проверка лицензии штата-резидента и подтверждение хорошей репутации — Если хорошая репутация не указана в проверке лицензии, предоставьте подтверждение хорошей репутации от лицензионного агентства штата-резидента
- Акт государственной проверки резидента
- Фармацевт-нерезидент, связанный с ответственным лицом:
- Должен иметь действующую PIC-регистрацию нерезидента в Аптечном совете OR
- Подать онлайн-заявку на регистрацию PIC нерезидента
- Лицензия штата-резидента фармацевта-нерезидента — Если хорошая репутация не указана в лицензии, необходимо предоставить подтверждение хорошей репутации от лицензионного агентства штата-резидента
- Владельцы и партнеры
- Копия этикетки с рецептом — имя (или имена) и адрес на этикетке с рецептом должны совпадать с именем (или именами) и адресом, указанными в заявке.
- Федеральная регистрация DEA — Если применимо
- Сертификат об отсутствии отпуска контролируемого вещества — если применимо
- Список врачей по контракту — если применимо
ИДАПА 24.36.01.600 Контролируемые вещества: PDMP
Уточненные данные о контролируемых веществах должны быть сообщены к концу следующего рабочего дня во все аптеки, которые отпускают контролируемые вещества в Айдахо или в Айдахо, и лица, выписывающие рецепты, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Требования к заявкам и необходимые документы
- Проверка лицензии штата-резидента и подтверждение хорошей репутации — Если хорошая репутация не указана в проверке лицензии, предоставьте подтверждение хорошей репутации от лицензионного агентства штата-резидента
- Акт государственной проверки резидента
- Фармацевт-нерезидент, связанный с ответственным лицом:
- Должен иметь действующую PIC-регистрацию нерезидента в Аптечном совете OR
- Подать онлайн-заявку на регистрацию PIC нерезидента
- Лицензия штата-резидента фармацевта-нерезидента — Если хорошая репутация не указана в лицензии, необходимо предоставить подтверждение хорошей репутации от лицензионного агентства штата-резидента
- Владельцы и партнеры
- Список подрядных компаний и / или больниц
ИДАПА 24.36.01.600 Контролируемые вещества: PDMP
Уточненные данные о контролируемых веществах должны быть сообщены к концу следующего рабочего дня во все аптеки, которые отпускают контролируемые вещества в Айдахо или в Айдахо, и лица, выписывающие рецепты, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Требования к заявкам и необходимые документы
- Лицензия на проживание
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо.Приемлемые отчеты включают
- Резидентская государственная инспекция
- Аттестат аккредитации НАБП
- Инспекция FDA
- Федеральная регистрация DEA — Если применимо
- 503 B Регистрация FDA
- Информация о владельцах и партнерах
- Только за пределами штата Фармацевт-нерезидент, являющийся ответственным лицом:
- Должен иметь действующую PIC-регистрацию нерезидента в Аптечном совете OR
- Подать онлайн-заявку на регистрацию PIC нерезидента
Требования к отчетности
Согласно правилам Совета Айдахо, отчеты о распределении рецептурных и контролируемых лекарственных препаратов, отправляемых практикующим врачам Айдахо, должны составляться ежемесячно.Отчеты можно отправлять по адресу [email protected]
Форма отчетности о продажах по рецепту
Часто задаваемые вопросы по отчетности
Для смены владельца необходимо подать заявление о смене владельца в Аптечный совет в течение (30) (тридцати) изменения.
Чтобы отправить изменение адреса или смены владельца:
- Получите перечисленные выше документы для новой регистрации
- Войдите на наш онлайн-портал лицензирования, используя учетные данные для вашей текущей лицензии / регистрации
- Нажмите «Первоначальное приложение» и выберите «Смена адреса» или «Смена владельца». Получено методом после выбора «Аптека» и желаемого типа лицензии / регистрации.
- Следуйте инструкциям на экране, чтобы заполнить заявку.
Плата за заполнение данной формы не взимается
Политика совета директоровтребует подачи этого заявления в фармацевтический совет в течение тридцати (30) дней с даты изменения.
Инструкции по подаче заявки на изменение имени
- Заполните форму изменения названия объекта.
- Получите следующую документацию. ПРИМЕЧАНИЕ: вся новая документация должна содержать новое имя.
- Лицензия на проживание
- Регистрация Федерального агентства по борьбе с наркотиками
- Копия рецептурной этикетки — только в аптеке государственной почты
- Войдите, используя свои учетные данные на нашем онлайн-портале, и завершите процесс обновления лицензии для вашей лицензии / регистрации.
- Выберите «Обновление лицензии» в меню
- Выберите соответствующий объект Лицензия / регистрация
- Следуйте инструкциям, чтобы перейти на страницу «Прикрепить документы».
- Загрузите заполненную форму изменения имени и дополнительную документацию
- Отправьте обновление лицензии.
- Отправьте письмо по адресу [email protected]. В теме письма следует указать название учреждения и номер лицензии / регистрации.
Важное примечание. При изменении названия объекта в результате смены владельца необходимо подать онлайн-заявку через учетную запись электронного правительства для существующего объекта, лицензированного в Айдахо. Затем необходимо загрузить форму изменения имени в приложение
для смены владельца. Письменное уведомление на фирменном бланке компании, включая название, лицензию / регистрационный номер Айдахо и дату закрытия, должно быть отправлено по адресу [email protected] за десять (10) дней до закрытияПроизводители и оптовики
Чтобы подать заявку на новую регистрацию или продлить текущую регистрацию, посетите наш онлайн-портал лицензирования.Требования к заявкам и необходимые документы
- Лицензия на проживание — для заявителей за пределами штата
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо.Приемлемые отчеты включают
- Резидентская государственная инспекция
- Аттестат аккредитации НАБП
- Инспекция FDA
- Регулирующие органы штата-резидента, которые не регулируют деятельность предприятия: письмо от регулирующего органа и / или кодекса или законов штата-резидента, указывающее на отсутствие надзора за этой деятельностью.
- Федеральная регистрация DEA — Если применимо
- Регистрация FDA
- Лекарства или продукты, одобренные FDA — Список лекарств должен включать номера NDC.
- Счет-фактура отгрузки — Счет-фактура должна быть копией счета-фактуры, предназначенной для использования в Айдахо, и включать имя и физический адрес заявителя
- Информация о владельцах и партнерах
IDAPA 24.36.01.600 Контролируемые вещества: PDMP
Указанные данные о контролируемых веществах должны быть предоставлены к концу следующего рабочего дня всеми аптеками, которые распределяют контролируемые вещества в Айдахо или в Айдахо, и лицами, назначающими лекарства, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Требования к заявкам и необходимые документы
- Лицензия на проживание в штате — Только за пределами штата
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо. Приемлемые отчеты включают
- Резидентская государственная инспекция
- Отчет об инспекции NABP VPP
- Инспекция FDA
- Сторонние логистические сертификаты VAWD
- Федеральная регистрация DEA — Если применимо
- Лекарства или продукты, одобренные FDA — Список лекарств должен включать номера NDC.
- Счет-фактура отгрузки — Счет-фактура должна быть копией счета-фактуры, предназначенной для использования в Айдахо, и включать имя и физический адрес заявителя
- Контрактные производители — Список контрактных производителей должен содержать полное название, адрес, регистрационный номер FDA и дату истечения срока действия
- Связанная сторонняя логистика (3PL) — Список 3PL должен включать полное имя, физический адрес и сертификат VAWD
- Информация о владельцах и партнерах
ИДАПА 24.36.01.600 Контролируемые вещества: PDMP
Уточненные данные о контролируемых веществах должны быть сообщены к концу следующего рабочего дня во все аптеки, которые отпускают контролируемые вещества в Айдахо или в Айдахо, и лица, выписывающие рецепты, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Требования к заявкам и необходимые документы
- Лицензия на проживание в штате — Только за пределами штата
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо.Приемлемые отчеты включают
- Резидентская государственная инспекция
- Свидетельство об аккредитации VAWD
- Федеральная регистрация DEA — Если применимо
- Счет-фактура отгрузки — Счет-фактура должна быть копией счета-фактуры, предназначенной для использования в Айдахо, и включать имя и физический адрес заявителя
- Назначенный представитель, связанный с объектом:
- Должен иметь номер назначенного представителя в Аптечном совете OR
- Подать онлайн-заявку уполномоченного представителя
- Информация о владельцах и партнерах
ИДАПА 24.36.01.600 Контролируемые вещества: PDMP
Уточненные данные о контролируемых веществах должны быть сообщены к концу следующего рабочего дня во все аптеки, которые отпускают контролируемые вещества в Айдахо или в Айдахо, и лица, выписывающие рецепты, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Требования к заявкам и необходимые документы
- Лицензия на проживание в штате — Только за пределами штата
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо.Приемлемые отчеты включают
- Резидентская государственная инспекция
- Оптовый продавец LMD — Аккредитация дистрибьютора лекарств NABP ранее VAWD Сертификат
- Оптовый торговец безрецептурным медицинским оборудованием — Аккредитация дистрибьютора медицинского оборудования NABP OTC ранее Сертификат VDIP
- Регулирующие органы штата-резидента, которые не регулируют деятельность предприятия: письмо от регулирующего органа и / или кодекса или законов штата-резидента, указывающее на отсутствие надзора за этой деятельностью.
- Счет-фактура отгрузки — Счет-фактура должна быть копией счета-фактуры, предназначенной для использования в Айдахо, и включать имя и физический адрес заявителя
- Информация о владельцах и партнерах
Аптеки
Чтобы подать заявку на новую регистрацию или продлить текущую регистрацию, посетите наш онлайн-портал лицензирования.Требования к заявкам и необходимые документы
- Лицензия на проживание в штате — Только за пределами штата
- Отчет об инспекции объекта штата-резидента — Не применяется для объектов в штате Айдахо.Приемлемые отчеты включают
- Резидентская государственная инспекция
- Сертификат организации по аккредитации Medicare
- Информация о владельцах и партнерах
Чтобы подать заявку на новую регистрацию или продлить текущую регистрацию, посетите наш онлайн-портал лицензирования.
Требования к заявкам и необходимые документы
- Ответственный ветеринарный врач — Для учреждений, выдающих контролируемые вещества.У ответственного лица, выписывающего рецепты, должен быть практикующий специалист по регистрации контролируемых веществ в Айдахо по адресу .
- Список врачей, выписывающих рецепты — Список должен включать всех врачей, выписывающих рецепты, в учреждении
- Поставщики — Должны включать полное имя, адрес и регистрационный номер Айдахо
- Информация о владельцах и партнерах
IDAPA 24.36.01.600 Контролируемые вещества: PDMP
Указанные данные о контролируемых веществах должны быть предоставлены к концу следующего рабочего дня всеми аптеками, которые распределяют контролируемые вещества в Айдахо или в Айдахо, и лицами, назначающими лекарства, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Чтобы подать заявку на новую регистрацию или продлить текущую регистрацию, посетите наш онлайн-портал лицензирования.
Требования к заявкам и необходимые документы
- Ответственный врач — Для предприятий, выдающих контролируемые вещества. У ответственного лица, выписывающего рецепты, должен быть практикующий специалист по регистрации контролируемых веществ в Айдахо по адресу .
- Список врачей, выписывающих рецепты — Список должен включать всех врачей, выписывающих рецепты, в учреждении
- Поставщики — Должны включать полное имя, адрес и регистрационный номер Айдахо
- Сертификат об отсутствии дозирования контролируемых веществ — Если применимо
- Информация о владельцах и партнерах
ИДАПА 24.36.01.600 Контролируемые вещества: PDMP
Уточненные данные о контролируемых веществах должны быть сообщены к концу следующего рабочего дня во все аптеки, которые отпускают контролируемые вещества в Айдахо или в Айдахо, и лица, выписывающие рецепты, которые отпускают контролируемые вещества людям.
Аптечный совет. Контактное лицо для сообщения: [email protected] или позвоните по телефону 208.334.2356.
Новые формы проверки
дистрибьюторов с ограниченной ответственностью | Аптечный совет штата Айова
С 1 января 2019 года ни одно лицо, кроме лицензированного оптового дистрибьютора, лицензированной аптеки или практикующего специалиста, не может участвовать в любой из перечисленных здесь видов деятельности в этом штате без ограниченной лицензии дистрибьютора.Если операции проводятся в нескольких местах одним дистрибьютором, каждое место должно иметь отдельную лицензию. Заявитель должен подать заполненную заявку вместе с невозмещаемым сбором в размере 175 долларов США.
ТРЕБУЕТСЯ ЛИЦЕНЗИЯ— Лицо, занимающееся следующими видами деятельности, должно получить ограниченную лицензию дистрибьютора до распространения в Айове или в Айове:
а. Распространение медицинского газа или устройства оптом или пациенту в соответствии с заказом на лекарства, отпускаемые по рецепту.
г. Оптовая продажа лекарств для животных, отпускаемых по рецепту.
г. Оптовая продажа рецептурных лекарств или посредничество в оптовых продажах рецептурных лекарств производителем, партнером производителя, имеющим совместную лицензию, или переупаковщиком.
г. Распространение рецептурных препаратов внутри компании, в том числе в распределительных центрах аптечных сетей.
e. Оптовая продажа комбинированного продукта в соответствии с определением Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, медицинского удобного набора, жидкости или электролита для внутривенного введения, раствора для диализа, радиоактивного препарата или раствора для орошения или стерильной воды, отпускаемого только по рецепту .
ф. Распространение диализного раствора производителем или его агентом пациенту в соответствии с заказом на рецептурный препарат при условии, что лицензированная аптека обрабатывает заказ на рецептурный препарат.
ЛИЦЕНЗИЯДОПОЛНИТЕЛЬНАЯ — Лицо, занимающееся следующими видами деятельности, может, но не обязано, получить ограниченную лицензию дистрибьютора для распространения в Айове или на территории штата Айова:
а. Распространение безрецептурных лекарств или устройств по рецепту пациента или без него.б. Раздача медицинских устройств исключительно практикующему врачу для использования в ходе обычной профессиональной практики практикующего врача («профессиональное использование»).
г. Распределение крови и продуктов крови, не подпадающих под действие Федерального закона о безопасности цепочки поставок лекарств (DSCSA).
ИЗМЕНЕНИЯ В ЛИЦЕНЗИИ — Для изменения имени, владельца или местонахождения требуется подача заявления на получение ограниченной лицензии дистрибьютора и внесение платы.
Изменение местоположения в штате — если новое местоположение не было лицензированным дистрибьютором с ограниченными возможностями непосредственно перед переездом, вам необходимо выполнить самопроверку нового местоположения перед переездом.
Смена собственника — смена собственника происходит, когда владелец, указанный в самой последней заявке ограниченного дистрибьютора, изменяется или когда происходит изменение, затрагивающее контрольную долю владения владельца, указанного в последней заявке ограниченного дистрибьютора.
Заявления и бланки
Онлайн-приложения
- Портал для продления лицензии через Интернет. Для продления через Интернет требуется действующая кредитная или дебетовая карта (Visa, Mastercard или Discover).За онлайн-продление и оплату взимается комиссия в размере 2,00 доллара США. Сертификат на продление будет отправлен по почте в течение нескольких дней после онлайн-продления.
- Первоначальное онлайн-приложение для новых ограниченных дистрибьюторов (Это приложение должно использоваться только кандидатами, которые никогда не получали лицензию в Айове, в текущем местоположении предприятия, в качестве ограниченного дистрибьютора.)
Приложения для бумаги
Подайте заполненное заявление с любой необходимой документацией и чеком или денежным переводом, подлежащим уплате в Аптечный совет штата Айова за невозвращаемую плату.
Для получения дополнительной информации или вопросов, пожалуйста, используйте онлайн-форму для связи с сотрудниками Правления.
Импорт и экспорт товаров медицинского назначения для коммерческого использования (GUI-0117)
21 декабря 2020
GUI-0117 версия 1, Руководящий документ о требованиях к ввозу товаров медицинского назначения в соответствии с Законом о пищевых продуктах и лекарствах и его Положениями (GUI-0084), Политика импорта и экспорта товаров медицинского назначения согласно Закону о пищевых продуктах и лекарствах и его Правила (POL-0060), Подход к соблюдению пограничных требований (POL-0059) и Политика ввоза или продажи активных фармацевтических ингредиентов для ветеринарного использования (POL-0018).
Министерство здравоохранения Канады — это федеральный департамент, отвечающий за помощь жителям Канады в поддержании и улучшении своего здоровья. Мы оцениваем безопасность лекарств и многих потребительских товаров, помогаем повысить безопасность пищевых продуктов и предоставляем канадцам информацию, которая поможет им принимать здоровые решения. Мы предоставляем медицинские услуги представителям коренных народов и инуитским общинам. Мы работаем с провинциями, чтобы наша система здравоохранения удовлетворяла потребности канадцев.
Également disponible en français sous le titre:
Импортер и экспортер чистой коммерческой продукции
За дополнительной информацией обращайтесь:
Министерство здравоохранения Канады
Локатор адресов 0900C2, Оттава, ON K1A 0K9
Тел.: 613-957-299
Бесплатный номер: 1-866-225-0709
Факс: 613-941-5366
Телетайп: 1-800-465-7735
Эл. Почта: [email protected]
Эта публикация может быть предоставлена в альтернативных форматах по запросу.
© Ее Величество Королева Справа Канады в лице министра здравоохранения, 2019 г.
Дата публикации: 28 октября 2019 г.
Данная публикация может быть воспроизведена только для личного или внутреннего использования без разрешения при условии полной ссылки на источник.
Кат .: h239-3 / 2019E-PDF
ISBN: 978-0-660-31235-4
Издательство: 1
Заявление об ограничении ответственности
Этот документ не является частью Закона о пищевых продуктах и лекарствах (Закон и его постановления), и в случае любого несоответствия или противоречия между Законом или постановлениями и настоящим документом, Закон или постановления имеют преимущественную силу. Этот документ является административным документом, который призван облегчить соблюдение регулируемой стороной Закона, нормативных актов и применимых административных политик.
Содержание
- Назначение
- Область применения
- Роль импортера
- Роль правительства Канады
- Импорт для коммерческого использования
- Требования к коммерческому ввозу
- Активные фармацевтические ингредиенты (API) для человека
- Лекарства для человека
- Натуральные продукты для здоровья
- API для ветеринарии
- Ветеринарные препараты и ветеринарные товары для здоровья
- Медицинское оборудование
- Кровь и компоненты крови для переливания
- Клетки, ткани и органы (CTO) для трансплантации
- Сперма для вспомогательного зачатия
- Предварительное уведомление о ввозе несоответствующих лекарственных препаратов (раздел A.01.044 FDR)
- Предварительное уведомление об импорте медицинских изделий с несоответствующей маркировкой (раздел 21.1 MDR)
- Импорт иностранных лекарственных средств для упаковки и маркировки в Канаде
- Экспорт товаров для здоровья
- Экспорт лицензионных товаров для здоровья
- Экспорт нелицензионных товаров для здоровья
- Продукция канадского производства на экспорт
- Товары в пути
- Приложения
- Приложение A: Глоссарий
- Аббревиатуры
- Условия
- Приложение B: Свяжитесь с нами
- Приложение C: Ссылки
- Законы
- Политические и руководящие документы
- Бланки заявлений
- Другое
В следующей таблице показаны два типа значков, используемых в этом документе, и способы их использования:
Важно: Ключевая или предостерегающая информация для людей.
Информация: Дополнительная информация, например цитаты и юридические ссылки.
Назначение
В этом руководящем документе содержится информация о том, как обеспечить соответствие товаров медицинского назначения, которые вы ввозите в Канаду для коммерческого использования, нормативным требованиям Закона о пищевых продуктах и лекарствах (Закон) (Закон) и связанных с ним нормативных актов на момент импорта.
В руководстве также представлена информация об экспорте товаров медицинского назначения из Канады для коммерческого использования.Товары для здоровья включают активные фармацевтические ингредиенты; лекарства для человека; ветеринарные препараты; медицинское оборудование; натуральные продукты для здоровья; кровь и компоненты крови для переливания; и человеческие клетки, ткани и органы для трансплантации.
Это руководство:
- определяет коммерческое использование, а
- излагает требования к импорту и экспорту товаров медицинского назначения в Канаду и из Канады для коммерческого использования.
Объем
Этот руководящий документ применяется к любому лицу, включая физическое лицо или организацию, которые импортируют или экспортируют товары медицинского назначения для коммерческих целей, например:
- розничные торговцы, дистрибьюторы или другие коммерческие предприятия, которые продают, производят, упаковывают, маркируют и тестируют товары для здоровья;
- независимых торговых подрядчиков или прямых продавцов;
- медицинских работников или исследователей клинических исследований; или
- человек импортируют количества, не предназначенные для личного пользования (как описано в разделе «Ввоз товаров медицинского назначения в Канаду для личного использования» (GUI-0116)), на основании инструкций по применению или разумного потребления.
В этом руководящем документе рассматриваются только требования Закона и связанных с ним Правил для товаров медицинского назначения. Некоторые товары для здоровья также могут иметь дополнительные ограничения, налагаемые на них другими законами / постановлениями / конвенциями, такими как Закон о контролируемых наркотических средствах и веществах , Положения о контроле над наркотиками и Конвенция о международной торговле видами дикой фауны и флоры, находящимися под угрозой исчезновения. . Вы несете ответственность за соблюдение всех требований правительства Канады.
Ранее донорская сперма для вспомогательного зачатия была классифицирована как лекарственное средство в соответствии с Законом и Положением об обработке и распределении спермы для вспомогательного зачатия (Положения о семени). С 4 февраля 2020 года Правила о семени отменены и заменены новыми Правилами безопасности спермы и яйцеклеток (Правила безопасности), принятыми в соответствии с Законом о вспомогательной репродукции человека . Для получения дополнительной информации об импорте спермы и яйцеклеток для коммерческого использования см. Руководящий документ — Правила безопасности спермы и яйцеклеток.
Роль импортера
Импортеры несут ответственность за обеспечение того, чтобы товары медицинского назначения, импортируемые для продажи, соответствовали требованиям Закона и его Положений во время импорта. Прежде чем импортировать товары для здоровья в Канаду, импортеры должны убедиться, что товары для здоровья, которые они ввозят, разрешены на рынке в Канаде, где это применимо, и импортируются лицами, имеющими соответствующую лицензию. Продукты должны быть изготовлены, упакованы, маркированы и испытаны на зарубежных предприятиях, соответствующих требованиям, и должны иметь разрешенную в Канаде маркировку.
Убедитесь, что поставки товаров для здоровья сопровождаются во время импорта всей информацией, подтверждающей соблюдение канадских законов. Инспекторы Министерства здравоохранения Канады определяют соответствие груза требованиям на основе информации, доступной на момент ввоза. Например, копия лицензии на предприятие / участок с подтверждением наличия авторизованного экспортера / импортера важна для идентификации предприятий, отвечающих требованиям надлежащей производственной практики (GMP), а также любых конкретных разрешительных писем (например.грамм. Письмо об отсутствии возражений для клинических испытаний).
Роль правительства Канады
Министерство здравоохранения Канады несет ответственность за мониторинг соответствия и правоприменительную деятельность в отношении товаров для здоровья, чтобы убедиться, что нормативные требования выполняются надлежащим образом.
Импорт: Любое действие, в результате которого товар пересекает канадскую границу из-за пределов Канады, независимо от того, находится ли он под таможенным залогом.
Экспорт: Отправка или транспортировка товаров для здоровья за границу, а также продажа или реклама товаров для здоровья через Интернет в иностранную юрисдикцию.
Health Canada работает в партнерстве с Канадским агентством пограничных служб (CBSA), чтобы оценить соответствие рекомендованных медицинских товаров на границе Закону и его положениям, чтобы гарантировать, что импортируемые товары для здоровья являются безопасными, эффективными и высококачественными.
Сотрудники таможни CBSA могут задерживать любой продукт медицинского назначения, который, по их мнению, не соответствует Закону и его положениям, используя свои полномочия, как описано в разделе 101 Закона о таможне .
CBSA может затем связаться с Министерством здравоохранения Канады, чтобы подтвердить, соответствует ли продукт требованиям к импорту, изложенным в Законе и его Положениях. Продукты медицинского назначения, признанные несоответствующими во время проверки Министерства здравоохранения Канады, будут отклонены во въезде или изъяты. Чтобы проверить, соответствует ли продукт требованиям, Министерство здравоохранения Канады оценит продукт и примет решение о допустимости. Оценка может включать отбор образцов продукта для лабораторного анализа, чтобы подтвердить состав продукта и то, что он не фальсифицирован неопределенным ингредиентом (например,грамм. рецептурный препарат в добавке к здоровью). Министерство здравоохранения Канады также может связаться с вами для получения копий соответствующих записей или документов. Чтобы избежать возможных задержек на границе, Министерство здравоохранения Канады рекомендует, чтобы вся соответствующая информация о продукте и лицах, уполномоченных на импорт (или экспорт) продукта, была включена в груз во время импорта.
Закон предоставляет Министерству здравоохранения Канады право изымать и задерживать любые товары для здоровья, которые, как считается, противоречат Закону или его Постановлениям.Министерство здравоохранения Канады также имеет право приказать вывозить незаконно ввезенные товары из Канады или, если вывоз невозможен, приказать уничтожить товары.
Health Canada уведомит вас и CBSA в письменной форме о результатах проверки, если ваш продукт (-ы) будет признан неприемлемым для ввоза в Канаду, включая любое уведомление об изъятии (если применимо) и варианты утилизации, если применимо.
Примечание: В соответствии с разделом 30.7 (1) Закона Министерство здравоохранения Канады может взыскать расходы, связанные с хранением, транспортировкой или утилизацией конфискованных товаров, а также с удалением или уничтожением незаконно ввезенных товаров от владельца или импортера или лица, владеющего им. , уход или контроль за товарами во время проверки.Кроме того, Health Canada не несет ответственности за какие-либо последствия, включая финансовые потери в результате определения приемлемости, сделанного в соответствии с его полномочиями в соответствии с Законом.
Импорт для коммерческого использования
Поставки товаров медицинского назначения могут рассматриваться как коммерческий импорт, если они предназначены для:
- Розничный торговец, дистрибьютор или другое коммерческое предприятие, включая независимых торговых подрядчиков или дистрибьюторов.
- Медицинские работники для использования в своей практике.
- Медицинский работник или квалифицированный исследователь для использования в клинических или экспериментальных исследованиях.
- Медицинский работник в рамках Программы особого доступа (позволяет иностранным производителям продавать лекарства или медицинские устройства, не одобренные для продажи в Канаде, медицинским работникам для лечения серьезных опасных для жизни состояний отдельных пациентов для оказания неотложной помощи, когда обычные методы лечения не работают, не подходят или недоступен).
- Медицинский работник в рамках Программы экстренного выпуска лекарств (позволяет иностранным производителям продавать ветеринарам новые лекарства, не одобренные в Канаде).
- Владелец лицензии фармацевтического предприятия через систему регулирования доступа к лекарствам в исключительных обстоятельствах (также известную как «Лекарства для неотложных нужд общественного здравоохранения»)
- Лицо, чья посылка сопровождается материалами, предназначенными для использования в рекламных или рекламных целях.
- Лицо, поставка которого содержит продукт для здоровья, необоснованное количество для личного использования которого превышает 90-дневный запас, основанный на инструкциях по применению продукта или предписанной дозировке.
- Лицо, поставка которого является частью повторных поставок того же продукта для здоровья, полученного в течение 90-дневного периода, совокупное количество которого превышает 90-дневный запас на основании инструкций по применению продукта или предписанной дозировки.
- Розничный торговец, дистрибьютор или другое коммерческое учреждение, медицинский работник или лицо, которое намеревается экспортировать товары для здоровья (не включая товары для здоровья, перегружаемые в соответствии с разделом 38 Закона — см. Товары в пути).
- Лицо, которое запрашивает и передает заказы иностранному поставщику, намеревается продать или отдать любое количество товаров для здоровья (за исключением консолидированных поставок, как определено ниже).
Примечание: Этот список не является исчерпывающим, и в процессе определения приемлемости могут приниматься во внимание другие факторы.
Консолидированная отгрузка означает несколько отдельных отправлений, сгруппированных вместе консолидатором или экспедитором и отправленных агенту или экспедитору как одна партия по одному коносаменту и сообщенных таможне в одном документе о контроле груза.Деконсолидация — это процесс, при котором консолидированная отгрузка разделяется на отдельные отгрузки, отправляемые различным получателям.
Экспортер за пределами Канады, который желает объединить несколько личных отправлений в консолидированную партию и отправить их через курьера или перевозчика в Канаду, может сделать это при условии, что каждая личная отправка предназначена для разных лиц. Личные посылки должны быть индивидуально упакованы и сопровождаться индивидуальными счетами-фактурами, чтобы Министерство здравоохранения Канады могло легко оценить их содержимое и определить, применяются ли требования коммерческого лицензирования.При оценке консолидированных отправлений Министерство здравоохранения Канады также будет учитывать другие факторы, например, кто организует ввоз, прием заказов и распределение, чтобы определить, является ли это коммерческим отправлением или объединением личных отправлений.
Требования к коммерческому ввозу
Для облегчения приемлемости важно работать с брокерами / курьерами, чтобы обеспечить наличие достаточной документации, сопровождающей ваш груз, для Health Canada для определения его приемлемости.Подтверждающие документы и информация о продукте могут включать:
- соответствующая маркировка с номером разрешения на продажу (например, идентификационный номер лекарства (DIN), номер натурального продукта (NPN))
- счетов-фактур / таможенных документов, подтверждающих авторизованных или лицензированных поставщиков / импортеров
Импортеры должны обеспечить, чтобы ссылки на соответствующие номера лицензий на продукты, номера лицензий предприятий или другие импортные документы, выданные Health Canada, были либо указаны в поставке, либо их копия была предоставлена вместе с отправкой, чтобы гарантировать, что CBSA и Health Canada имеют необходимая информация для своевременного определения приемлемости.В следующих таблицах (с 1 по 8) изложены требования к лицензированию продуктов, лицензированию предприятий или другие требования к коммерческому импорту продуктов медицинского назначения, регулируемых Законом и его Положениями.
Активные фармацевтические ингредиенты (API) для человека
Активные ингредиенты — это вещества в лекарствах, которые оказывают благотворное влияние на здоровье потребителей. Активный ингредиент фармацевтического препарата называется активным фармацевтическим ингредиентом (API).Примером API является ацетаминофен, содержащийся в таблетке для снятия боли. API регулируются Министерством здравоохранения Канады в соответствии с Законом о пищевых продуктах и лекарствах (FDR). Требования к импорту API приведены в таблице 1.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Активные фармацевтические ингредиенты (API) | Не применимо |
| Контролируемые вещества (перечисленные в приложениях Закона о контролируемых наркотиках и веществах (CDSA)) имеют дополнительные ограничения в соответствии с CDSA, например: дилерская лицензия / разрешение. Проконсультируйтесь с Управлением контролируемых веществ Министерства здравоохранения Канады для получения информации о других возможных ограничениях. |
| Активные фармацевтические ингредиенты, используемые при производстве готовой лекарственной формы в клинических испытаниях | Не применимо | Не применимо | Письмо об отсутствии возражений (NOL) в отношении готовой лекарственной формы, выданное Управлением терапевтических продуктов Министерства здравоохранения Канады или Управлением биологических и радиофармацевтических препаратов, в зависимости от обстоятельств. Копия NOL должна быть включена в поставку. |
Лекарства для человека
Лекарства регулируются Министерством здравоохранения Канады в соответствии с законом и его постановлениями. К лекарствам относятся как рецептурные, так и безрецептурные препараты; продукты биологического происхождения, такие как вакцины, продукты, полученные из крови, и продукты, полученные с помощью биотехнологии; дезинфицирующие средства; и радиофармпрепараты. Хотя Natural Health Products (NHP) также являются лекарствами, они имеют другие требования к импорту и описаны отдельно в этом документе.
Лекарства для людей должны иметь восьмизначный (8) цифровой номер, называемый идентификационным номером лекарственного средства (DIN), присваиваемый Министерством здравоохранения Канады каждому лекарственному продукту до того, как он будет продаваться в Канаде.
Лекарства для людей без DIN могут ввозиться при следующих обстоятельствах:
- Если это разрешено в рамках клинического исследования, проводимого в Канаде, и выдается письмо об отсутствии возражений (NOL).
- По запросу практикующего специалиста в Программу специального доступа (SAP) через исключения, изложенные в C.08.010 и C.08.011 FDR. SAP рассматривает запросы на доступ к лекарствам, которые недоступны для продажи в Канаде, от врачей и стоматологов, лечащих пациентов с серьезными или опасными для жизни состояниями, когда обычные методы лечения не работают, являются неподходящими или недоступными. Решения о разрешении этого доступа основываются на обстоятельствах и деталях каждой ситуации. Если разрешение предоставлено, Министерство здравоохранения Канады направляет производителю препарата письмо о разрешении (LOA), разрешающее его продажу запрашивающему практикующему врачу.Копия этого письма отправляется практикующему. Копия этого письма должна быть отправлена вместе с посылкой, чтобы обеспечить своевременный ввоз препарата в Канаду.
- Посредством регулирующего механизма для доступа к лекарствам в исключительных обстоятельствах (также известных как лекарства для неотложной потребности общественного здравоохранения), который обеспечивает доступ к лекарствам, которые были разрешены для продажи в некоторых иностранных юрисдикциях, но недоступны в Канаде, для решения срочных проблем. потребности общественного здравоохранения. Требования к ввозу изложены в Таблице 2, а дополнительную информацию об этом пути регулирования можно найти в документе Вопросы и ответы — Доступ к лекарствам в исключительных обстоятельствах.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Биопрепараты (Приложение D FDR) | Идентификационный номер лекарства |
| Не применимо |
| Клинические испытания (кроме фазы IV) | Не применимо | Не применимо | Письмо об отсутствии возражений (NOL), выданное Управлением терапевтических продуктов Министерства здравоохранения Канады или Управлением по биологическим и радиофармацевтическим препаратам, в зависимости от обстоятельств.Копия NOL должна быть включена в поставку с указанием действующего контрольного номера на NOL. |
| Клинические испытания IV фазы | Идентификационный номер лекарства |
| Не применимо |
| Лекарства, отпускаемые без рецепта | Идентификационный номер лекарства |
| Не применимо |
| Лекарства, отпускаемые по рецепту | Идентификационный номер лекарства |
| Импортером должен быть практикующий врач, производитель лекарств, оптовый аптекарь или фармацевт. Лекарства, содержащие контролируемые вещества, имеют дополнительные ограничения в соответствии с Законом о контролируемых наркотиках и веществах . Проконсультируйтесь с Управлением контролируемых веществ Министерства здравоохранения Канады для получения информации о других возможных ограничениях. |
| Радиофармацевтические препараты (Приложение C FDR) | Идентификационный номер лекарства |
| Не применимо |
| Специальная программа доступа | Не применимо | Не применимо | Письмо-разрешение (LOA), выданное Программой специального доступа Министерства здравоохранения Канады. Копия LOA должна сопровождать груз. |
| Лекарства для неотложной медицинской помощи | Не применимо |
| Препарат должен соответствовать критериям, установленным в Списке неотложной медицинской помощи |
Натуральные продукты для здоровья
Натуральные продукты для здоровья (NHP) регулируются Министерством здравоохранения Канады в соответствии с Законом и Положением о натуральных продуктах для здоровья (NHPR) и должны быть лицензированы до продажи в Канаде.Лицензированным NHP присваивается восьмизначный номер натурального продукта (NPN) или номер гомеопатического лекарства (DIN-HM). Чтобы быть классифицированным как NHP, все лекарственные ингредиенты в продукте должны быть в Schedule 1 NHPR, не включать какие-либо вещества, перечисленные в Schedule 2 NHPR и продаваемые по причинам здоровья. В таблице 3 указаны требования к импорту НПЗ.
НПЗ включают народную медицину; пищевые добавки / витамины; минералы; и объемное сырье, произведенное, проданное или представленное для использования в качестве НПЗ.Косметика, содержащая ингредиенты NHP и отвечающая как функциональным, так и вещественным компонентам определения NHP, регулируется как NHP. Косметические продукты, не подпадающие под определение NHP (см. Приложение A), регулируются Положением по косметике Закона и находятся в ведении Косметической программы Министерства здравоохранения Канады.
| Лицензия на продукт | Лицензия на сайт | Прочие импортные требования | |
|---|---|---|---|
| НПЗ | NPN или DIN-HM |
| Не применимо |
| NHP, импортированный для использования в клинических испытаниях | Не применимо | Не применимо | Уведомление о разрешении (NoA), разрешающее использование продукта в клинических испытаниях, выданное Управлением по натуральным и безрецептурным продуктам медицинского назначения Министерства здравоохранения Канады. Копия NoA должна быть включена в поставку. |
API для ветеринарии
С 17 мая 2018 г. к импортерам API для ветеринарного использования применяются новые нормативные требования, в соответствии с которыми они теперь должны иметь лицензию на учреждение (EL) для этой деятельности.
Примерами API для ветеринарного использования являются такие ингредиенты, как кортикостероиды или антибиотики, содержащиеся в ушных каплях для лечения инфекции.
Новые требования EL также применяются к медицинским работникам, таким как ветеринары и фармацевты, которые импортируют API, перечисленные в Списке A Министерства здравоохранения Канады: Список определенных антимикробных активных фармацевтических ингредиентов для составления ветеринарных препаратов. В списке А перечислены некоторые антимикробные API, важные для медицины человека, для которых были введены дополнительные ограничения, чтобы ограничить развитие устойчивости к этим важным противомикробным препаратам.
Требования к импорту API для ветеринарного использования приведены в таблице 4.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Ветеринарные API | Не применимо |
| Не применимо |
| Ветеринарные API в списке A | Не применимо |
| Не применимо |
| Ветеринарные АФИ, импортированные и предназначенные для прямого введения животным (не включая вещества VHP) | Идентификационный номер лекарства |
| Массовые АФИ или сырье считаются лекарствами в конечной лекарственной форме, если они предназначены для прямого введения животным (например, местно, в воде, в корме) без дальнейшего смешивания фармацевтом или ветеринаром или производством. |
Ветеринарные препараты и ветеринарные товары для здоровья
Ветеринарные препараты, включая ветеринарные товары для здоровья (VHP), регулируются Министерством здравоохранения Канады в соответствии с Законом и FDR.Лицензированным ветеринарным препаратам присваивается восьмизначный идентификационный номер (DIN), аналогичный лекарственным препаратам для людей. Ветеринарные товары для здоровья представляют собой готовые к употреблению препараты с низким уровнем риска для поддержания здоровья и благополучия животных, произведенные в соответствии со Списком C: Ветеринарные товары для здоровья, и им предоставляется буквенно-цифровой номер уведомления (NN) после уведомления и разрешения Ветеринарных препаратов. Дирекция. Применимое предприятие и лицензирование продукта, необходимые для импорта ветеринарного препарата, указаны в таблице 5.
Ветеринарные препараты без DIN можно ввозить при следующих обстоятельствах:
- В рамках программы экстренного выпуска лекарств (EDR). EDR через исключения, изложенные в C.08.010 и C.08.011 FDR, позволяет практикующим врачам (т. Е. Тем, кто зарегистрирован и имеет право в соответствии с законами провинции заниматься профессией ветеринарной медицины), получать доступ к ветеринарным препаратам, у которых есть не получили в Канаде разрешения на обращение с животными своих клиентов.В таких случаях практикующие должны запросить разрешение EDR в Министерстве здравоохранения Канады. Копия этого разрешения должна сопровождать груз для своевременного ввоза препарата в Канаду.
- Согласно Сертификату экспериментальных исследований (ESC), выданному Министерством здравоохранения Канады исследователям для использования в экспериментальных исследованиях на животных. Копия этого разрешения должна сопровождать груз, чтобы обеспечить своевременный ввоз препарата в Канаду.
- Посредством письма об отсутствии возражений (NOL), выданного Министерством здравоохранения Канады исследователям для использования в исследовании нового лекарственного препарата на животных.Копия NOL должна сопровождать груз, чтобы обеспечить своевременный ввоз препарата в Канаду.
Подробная информация о требованиях к ввозу ветеринарных продуктов представлена в Таблице 5.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Сельскохозяйственные имплантаты, содержащие контролируемые препараты (анаболические стероиды или зеранол) | Идентификационный номер лекарства |
| Не применимо |
| Ветеринарные товары для здоровья | Номер уведомления | Не применимо | VHP необходимо уведомить во время ввоза и пометить в соответствии с требованиями FDR. |
| Лекарства, отпускаемые без рецепта | Идентификационный номер лекарства |
| Не применимо |
| Лекарства, отпускаемые по рецепту | Идентификационный номер лекарства |
| Импортером должен быть практикующий врач, производитель лекарств, оптовый аптекарь или фармацевт. |
| Продукты, импортированные для использования в клинических испытаниях (называемые новым исследуемым препаратом) | Не применимо | Не применимо | Письмо об отсутствии возражений (NOL), выдаваемое Управлением ветеринарных препаратов Министерства здравоохранения Канады для каждой партии груза. |
| Продукты, импортированные по Сертификату экспериментальных исследований (ESC) для использования в экспериментальных исследованиях | Не применимо | Не применимо | ESC, выданный Управлением ветеринарных препаратов Министерства здравоохранения Канады для каждого препарата. Копия этого разрешения должна быть предоставлена в порту въезда. |
| Продукция, импортированная в рамках программы экстренного выпуска лекарственных средств | Не применимо | Не применимо | Разрешение на выдачу лекарств в экстренных случаях, выданное Управлением ветеринарных препаратов Министерства здравоохранения Канады для каждой партии груза. |
| Лекарственные средства, содержащие вещества с эстрогенной активностью (эстроген / эстроген или производные эстрогена) | Импорт запрещен, если препарат предназначен для продажи домашней птице, которая может употребляться в пищу. | ||
| Лекарства, запрещенные для пищевых продуктов животного происхождения (например, хлорамфеникол или его соли или производные; соединение 5-нитрофурана; кленбутерол или его соли или производные; соединение 5-нитроимидазола; диэтилстильбестрол или другие соединения стильбена) | Импорт запрещен, если препарат предназначен для продажи животным, производящим пищевые продукты. | ||
Медицинское оборудование
Медицинские устройства регулируются Министерством здравоохранения Канады в соответствии с Законом и Положением о медицинских устройствах (MDR). Медицинские устройства подразделяются на четыре класса (I, II, III или IV) в зависимости от уровня риска, связанного с их использованием. Приборы класса I представляют наименьший потенциальный риск (например, термометры). Устройства класса IV представляют самый высокий потенциальный риск (например, кардиостимуляторы).
Health Canada выдает в Канаде два типа лицензий на медицинское оборудование.
- Лицензия на производство медицинских устройств (MDEL): лицензия, выданная предприятию, которое импортирует или продает медицинские устройства в Канаде. Сюда входят производители медицинских устройств класса I, а также импортеры и дистрибьюторы всех классов медицинских устройств.
MDEL выдается Управлением по медицинскому оборудованию и соблюдению клинических требований Министерства здравоохранения Канады (MDCCD).
РуководствоHealth Canada по лицензированию создания медицинских устройств и лицензионных сборов за создание медицинских устройств, GUI-0016, содержит руководство по всем аспектам MDEL и включает определения производителя, импортера и дистрибьютора.
- Лицензия на медицинское устройство (MDL): лицензия, выданная производителю, разрешающая продажу устройства класса II, III или IV в Канаде. Устройства класса I не требуют MDL.
MDL выдаются производителям устройств класса II, III или IV Управлением по медицинским устройствам (MDD) Министерства здравоохранения Канады на основании научных данных о качестве, безопасности и эффективности.
Для получения дополнительной информации о том, как получить MDL, обратитесь к Руководству: Как заполнить заявку на получение лицензии на новое медицинское устройство.
Импортируемое медицинское изделие должно иметь MDL, если оно относится к классу II, III или IV. Кроме того, импортерам любого Класса медицинского оборудования, которые предлагают медицинское устройство для продажи, требуется MDEL, если они не являются:
- розничный торговец;
- медицинское учреждение;
- производитель устройств класса I, который импортирует или распространяет устройства только класса I через кого-либо, у кого есть MDEL;
- производитель устройств класса II, III или IV, который продает только медицинские устройства, на которые у него есть действующая лицензия;
- человек, который только импортирует или продает ветеринарные приборы; Дозатор
- ; или
- человек, который импортирует или продает только устройства, изготовленные на заказ, медицинские устройства для специального доступа или устройства для исследовательских испытаний с участием людей.
Медицинские устройства без лицензии на медицинское оборудование могут быть импортированы по запросу профессионального медицинского работника в Программу специального доступа (SAP) с учетом исключений, изложенных в Части 2, Разделе 69-78 MDR. SAP рассматривает запросы специалистов здравоохранения о доступе к нелицензированным медицинским устройствам для экстренного использования в тех случаях, когда традиционные методы лечения не работают, недоступны или непригодны. Кроме того, SAP предоставляет разрешения на изготовление медицинских устройств, изготовленных по индивидуальному заказу, необходимых для особых условий пациента.Решения о разрешении этого доступа основываются на обстоятельствах и деталях каждой ситуации. Если разрешение предоставлено, Министерство здравоохранения Канады предоставляет изготовителю медицинского устройства письмо-заказ, разрешающее его продажу запрашивающему практикующему врачу. Копия этого письма отправляется практикующему. Копия этого письма должна быть отправлена вместе с грузом, чтобы обеспечить своевременный ввоз медицинского устройства в Канаду. В таблице 6 указаны требования Министерства здравоохранения Канады к ввозу медицинских устройств.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Класс I | Не применимо | Импортер должен иметь лицензию на производство медицинских устройств (MDEL) для осуществления деятельности по импорту, если он не освобожден.Изготовитель устройства класса I должен иметь MDEL для импорта, за исключением случаев, когда производитель импортирует или распространяет исключительно через кого-то еще, у кого есть MDEL | Не применимо |
| Класс II, III или IV | Лицензия на устройство | Импортер должен иметь MDEL для деятельности по импорту, если он не освобожден. | Не применимо |
| Исследовательские испытания на людях | Не применимо | Не применимо | Разрешение (LOA), выданное Управлением по медицинским устройствам Министерства здравоохранения Канады, должно сопровождать устройства класса II, III или IV в статусе исследовательского тестирования. Требовать идентификации как «исследуемое устройство» и «только для использования квалифицированными исследователями» на этикетке устройства. |
| Специальный доступ и приспособления под заказ | Не применимо | Не применимо | LOA, выданный Управлением по медицинским устройствам Министерства здравоохранения Канады, должен сопровождать все классы устройств специального доступа; и устройства класса III или IV, изготовленные на заказ. На этикетке устройства должно быть указано, что устройство изготовлено на заказ или для специального доступа. |
Кровь и компоненты крови для переливания
Кровь и компоненты крови для переливания регулируются Министерством здравоохранения Канады в соответствии с Законом и Положением о крови (требования к импорту см. В Таблице 7).
Образцы крови, импортированные для тестирования или исследований, не подпадают под юрисдикцию Министерства здравоохранения Канады, но могут потребовать разрешения на импорт от Агентства общественного здравоохранения Канады или CFIA, поскольку культуры, диагностические образцы или исследовательские ткани могут быть потенциальными носителями патогенов человека или животных.Пожалуйста, проконсультируйтесь с этими организациями для получения более подробной информации.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Кровь и компоненты крови для переливания | Не применимо | Импортер должен иметь лицензию на организацию крови (BEL) для осуществления деятельности по импорту. Иностранное представительство должно быть на BEL импортера. | Кровь и компоненты крови должны соответствовать требованиям Положения о крови . Если кровь и компоненты крови для переливания импортируются по рецепту, требования Положения о крови отменяются. Доказательство рецепта должно быть предоставлено в порту въезда. |
Клетки, ткани и органы (CTO) для трансплантации
Правила о безопасности человеческих клеток, тканей и органов при трансплантации (Правила CTO ) содержат требования безопасности в отношении импорта, а также обработки, хранения, распределения, ведения учета и т. Д. Правила CTO применяются только к СТО человека, которые будут использоваться при трансплантации. CTO, пожертвованные для различных целей, таких как образование или доклинические исследования, не подпадают под действие Регламента CTO .Требования к импорту CTO см. В Таблице 8.
| Лицензия на продукт | Лицензия на учреждение | Прочие импортные требования | |
|---|---|---|---|
| Островковые клетки и ткани | Не применимо | Не применимо | Импортирующему предприятию требуется регистрационный номер технического директора, если оно не является конечным пользователем. Exporting Source Establishment требует регистрационный номер технического директора. Название и регистрационный номер предприятия (предприятий) должны быть указаны на внешней стороне упаковки |
| Лимфогематопоэтические клетки (стволовые клетки) и органы | Не применимо | Не применимо | Из-за жизненно важных свойств и обстоятельств, связанных с этими продуктами, нет необходимости в регистрации продукта или экспортеров в Министерстве здравоохранения Канады. Импортеры должны быть зарегистрированы в Министерстве здравоохранения Канады. |
Регистрационный номер предприятия — это шестизначный (6) цифровой код, начинающийся с единицы (1), присвоенный утвержденному предприятию в соответствии с Положением CTO .
Как определено в разделе 1 Правил «Безопасность человеческих клеток, тканей и органов при трансплантации» , «Организация-источник» означает:
- с учетом пункта (b), в случае органа от умершего донора, соответствующая организация по донорству органов;
- в случае дополнительных сосудов, которые извлекаются вместе с органом и не используются сразу при трансплантации органа, соответствующий банк тканей;
- в случае органа от живого донора или лимфогематопоэтических клеток, которые не хранятся в банке, соответствующее учреждение по трансплантации;
- в случае тканей или банков лимфогематопоэтических клеток — соответствующий банк клеток или тканей; и
- в случае островковых клеток — учреждение, которое подготавливает клетки для использования в трансплантации.
Сперма для вспомогательного зачатия
Донорские сперматозоиды и яйцеклетки для вспомогательной репродукции человека регулируются Положением о безопасности спермы и яйцеклеток в соответствии с Законом об вспомогательной репродукции человека . Для получения дополнительной информации о требованиях к ввозу донорской спермы и яйцеклеток, пожалуйста, обратитесь к Руководящему документу Министерства здравоохранения Канады — Правила безопасности спермы и яйцеклеток.
Предварительное уведомление о ввозе несоответствующих лекарств (раздел A.01.044 FDR)
Импорт для продажи лекарств, не соответствующих требованиям, в том числе натуральных продуктов для здоровья, запрещен в соответствии с разделом A.01.040 FDR. Однако раздел A.01.044 FDR разрешает ввоз несоответствующих лекарств при соблюдении двух особых условий:
- Импортер заранее уведомляет инспектора Министерства здравоохранения Канады о предполагаемом ввозе (уведомление не может быть предоставлено на границе, так как уже считается импортированным в этот момент).
и
- Продукт переименован или модифицирован в соответствии с требованиями, чтобы его продажа была законной в Канаде.
Этот процесс не дает продуктам времени для получения разрешения на продажу в Канаде, так как модификации должны быть завершены в течение трех месяцев. Для получения дополнительной информации о разделе A.01.044 см. «Важная информация для заинтересованных сторон — Внедрение предварительного уведомления о пилотном процессе импорта косметических средств и лекарств».
Предварительное уведомление об импорте медицинских изделий с несоответствующей маркировкой (раздел 21.1 MDR)
Ввоз для продажи медицинского изделия с маркировкой, не соответствующей требованиям Раздела 21 (1) MDR, запрещен. Тем не менее, Раздел 21.1 MDR разрешает ввоз медицинских изделий, которые не имеют маркировки в соответствии с положениями:
- , если это лицо имеет лицензию на импорт медицинского устройства, оно направляет предварительное уведомление о предполагаемом импорте в Министерство здравоохранения Канады или, если у него нет такой лицензии, что производитель медицинского устройства отправляет предварительное уведомление; и
- перед продажей медицинского изделия, что производитель медицинского изделия перемаркировал его в соответствии с настоящими Правилами в течение трех месяцев с даты его ввоза.
Кроме того, любое лицо, которое импортирует для продажи медицинское устройство, которое не имеет маркировки в соответствии с настоящими Правилами, должно гарантировать, что производитель медицинского устройства уведомит Министерство здравоохранения Канады в письменной форме имя лица, которое будет перемаркировать его в Канаде, если он должен быть переименован от имени производителя.
«Предварительное уведомление о процессе импорта медицинских изделий» помогает производителям и импортерам выполнять требование об отправке предварительного уведомления о предполагаемом ввозе медицинских изделий с несоответствующей маркировкой на имя министра.Все остальные лицензионные требования продолжают применяться, в том числе: медицинское устройство: лицензировано для продажи в Канаде; импортированы от иностранного производителя или дистрибьютора, имеющего действующий MDEL; или, импортированные и проданные через сторону в Канаде, у которой есть действующий MDEL, за исключением случаев, предусмотренных S.44 (2) MDR. Для получения дополнительной информации о разделе 21.1 и Предварительном уведомлении о процессе импорта медицинских устройств, пожалуйста, обратитесь к разделу «Важная информация для заинтересованных сторон — Внедрение предварительного уведомления о процессе импорта медицинских устройств».
Импорт иностранных лекарств для упаковки и маркировки в Канаде
Если вы предоставляете услуги по упаковке и маркировке иностранным производителям лекарств, вы можете импортировать лекарства в лекарственных формах, которые не были одобрены для продажи в Канаде, при следующих условиях (все должны быть выполнены):
- У вас есть лицензия фармацевтического предприятия на упаковку / маркировку.
- Вы выполняете только упаковку / маркировку продукта.
- Вы экспортируете упакованные и маркированные лекарства обратно в страну происхождения.
- Неутвержденные препараты не продаются в Канаде.
- Вы не продаете лекарства в других странах.
- Зарубежный производитель или поставщик сохраняет право собственности на лекарства в периоды импорта, упаковки / маркировки и экспорта. Если продукт не будет возвращаться напрямую владельцу, необходимо предоставить доказательство права собственности, в противном случае экспорт может считаться распределением, и будут применяться канадские лицензионные требования.
Экспорт товаров для здоровья
Ниже описаны условия и требования, при которых товары для здоровья могут быть экспортированы из Канады. Вы должны убедиться, что вы экспортируете только те товары для здоровья, которые не представляют риска для здоровья и безопасности, являются эффективными и качественными. Как ответственный член мирового сообщества Министерство здравоохранения Канады должно поддерживать целостность соглашений и обязательств, взятых перед нашими международными партнерами, таких как Соглашения о взаимном признании (MRA).Для получения дополнительной информации посетите веб-сайт Министерства здравоохранения Канады: Соглашения о взаимном признании.
Экспорт лицензионных товаров для здоровья
Вы можете экспортировать продукт для здоровья, лицензированный Министерством здравоохранения Канады, при условии, что продажа продукта соответствует Закону и его Правилам. Как минимум, это означает, что продукт должен быть , а не :
.- фальсифицированный
- произведено в антисанитарных условиях
- изготовлено, продано или рекламируется ложным, вводящим в заблуждение или вводящим в заблуждение способом
- вредно для здоровья пользователей
Для лекарства это означает, что продукт должен быть произведен в соответствии с требованиями Надлежащей производственной практики (GMP), изложенными в FDR, и что предприятие должно иметь EL.
По запросу Министерство здравоохранения Канады может выдавать лицензированные товары для здоровья:
- Сертификат фармацевтического продукта (CPP) на лекарства, или
- Экспортный сертификат производителя (MCE) на медицинские изделия
Министерство здравоохранения Канады выдает эти сертификаты производителям для облегчения процесса экспорта в качестве услуги канадской медицинской промышленности и фармацевтической промышленности.
Обратитесь к следующим руководствам на веб-сайте Министерства здравоохранения Канады, чтобы запросить CPP или MCE:
Экспорт нелицензионных товаров для здоровья
Продукция канадского производства на экспорт
Если вы производите или готовите продукт для здоровья в Канаде, включая активный фармацевтический ингредиент, предназначенный только для экспорта, вы должны соблюдать Закон и его Положения.
Если продукты отправляются партнеру MRA и они подпадают под действие MRA, то продукты должны и дальше производиться в соответствии с Законом и его Положениями.
Для того, чтобы лекарственные препараты и активные фармацевтические ингредиенты соответствовали Закону и его положениям, должны быть выполнены следующие условия:
- продукция производится в соответствии с требованиями GMP Сайт
- имеет лицензию на создание
- производитель должен подтвердить, что продукт не противоречит никаким законам страны-импортера
Если вам требуется освобождение от требований какого-либо закона или его положений, чтобы соответствовать законам или требованиям страны, в которую отправляются продукты, вы можете воспользоваться разделом 37 Закона.
Согласно статье 37, экспорт освобождается от действия Закона при следующих условиях:
- Медицинский продукт должен быть произведен или изготовлен в Канаде.
- Медицинский продукт должен быть предназначен только для экспорта и не должен производиться, готовиться или продаваться для потребления или использования в Канаде.
- У вас есть экспортный сертификат, нотариально заверенный и подтверждающий, что упаковка и ее содержимое не противоречат каким-либо известным требованиям законодательства страны-импортера (см. Приложение III FDR или Приложение 3 к Правилам по медицинскому оборудованию ).
- Лекарственные препараты, производимые в Канаде на экспорт, не могут быть фальсифицированы, изготовлены в антисанитарных условиях, а также упакованы или маркированы способом, вводящим в заблуждение или вводящим в заблуждение (раздел 37 (1.1) (b) Закона).
- Медицинские устройства, которые производятся в Канаде для экспорта, не могут причинить вред здоровью покупателя / пользователя при использовании в соответствии с инструкциями или обычном использовании, а также не могут быть упакованы или маркированы способом, вводящим в заблуждение или вводящим в заблуждение (раздел 37 (1.1) (г) Закона).
Обратите внимание, что сертификат фармацевтического продукта или сертификат производителя медицинского устройства не будет выдаваться Министерством здравоохранения Канады для медицинского продукта, на который требуется исключение из Закона в соответствии с разделом 37.
Вы должны уведомить Health Canada о своем намерении использовать раздел 37, используя форму под названием Экспортный сертификат на лекарства, экспортируемые в соответствии с разделом 37 Закона о пищевых продуктах и лекарствах (FRM-0038). Если вы используете раздел 37:
- партий продукции, предназначенных только для экспорта и упаковка которых еще не завершена, должны быть четко обозначены как таковые, например, путем письменного указания в производственном заказе или контейнерах для массовых грузов
- , вы должны хранить производственные записи и копии экспортных сертификатов в своих помещениях и предоставлять их инспекторам Министерства здравоохранения Канады до или во время проверки .
Если вы решите использовать раздел 37 и у вас есть экспортный сертификат, товары для здоровья не подлежат проверке. Министерство здравоохранения Канады будет указывать иностранным регулирующим органам те продукты, в отношении которых вы уведомили Министерство здравоохранения Канады о своем намерении использовать раздел 37.
Раздел 37 не может использоваться для продуктов, подпадающих под действие соглашения о взаимном признании (MRA), которые отправляются партнеру MRA. Если вы используете раздел 37, эти товары для здоровья исключены из любых MRA; это означает, что вы не можете получить выгоду от договоренностей по MRA.
Изъятия в соответствии с разделом 37 не применяются к импортируемым товарам. Если вы импортируете продукты в Канаду с целью производства продукта для экспорта, продукт, который вы импортируете, должен соответствовать Закону на момент импорта, а импортер должен иметь соответствующую лицензию.
Товары в пути
Транспортировка товаров для здоровья освобождается от уплаты в соответствии с разделом 38 Закона, если товары соответствуют следующим условиям:
- Произведено или изготовлено за пределами Канады.
- Импортируется исключительно с целью экспорта и не продается для потребления или использования в Канаде.
и
- Отвечает требованиям статьи 38 (c) Закона.
Раздел 38 Закона не применяется к товарам медицинского назначения, которые импортируются для дальнейшего производства, маркировки или упаковки (то есть не только для экспорта), независимо от того, предназначены ли товары для экспорта или ввозятся в Канаду под залог.Продукты, которые ввозятся в Канаду в качестве перевалки, должны находиться под залогом CBSA и оставаться под залогом до тех пор, пока не будут экспортированы из Канады.
Следующие примеры включены, чтобы помочь прояснить применение статьи 38 Закона:
Пример 1:
Компания хочет, чтобы партия товаров для здоровья проходила через Канаду из страны А по пути в страну Б. По причинам логистики партия должна пройти через Канаду. Ввоз может быть разрешен, если:
- В поставку входят товары для здоровья, полностью соответствующие канадским нормативным требованиям (например,грамм. DIN, двуязычная маркировка, лицензия импортера) на месте.
или
- Груз содержит товары для здоровья, которые не соответствуют нормативным требованиям Канады, но просто следуют транзитом через Канаду, чтобы завершить путешествие, начинающееся и заканчивающееся за пределами Канады. Кроме того, продукты не подвергаются лицензируемой деятельности, такой как изготовление, упаковка / маркировка, распространение, оптовая продажа или тестирование в Канаде без надлежащего EL.
Пример 2:
Компания хочет иметь партию нелицензионных товаров для здоровья, импортированных для доставки на склад. Товары не будут продаваться канадцам. Получая заказы от иностранных клиентов, компания будет выполнять заказы и экспортировать нелицензированные товары для здоровья иностранным клиентам.
Этот ввоз не считается перевалкой, поскольку продажа осуществляется в Канаде. В этом случае продукты не могут быть импортированы без соблюдения нормативных требований Канады (например,грамм. EL, лицензия на продукт, соответствующая маркировка).
Приложения
Приложение A: Глоссарий
Сокращения
- API
- Активный фармацевтический ингредиент
- BEL
- Лицензия учреждения крови
- CBSA
- Управление пограничной службы Канады
- CDSA
- Закон о контролируемых наркотиках и веществах
- CFIA
- Канадское агентство по надзору за пищевыми продуктами
- CPP
- Сертификат фармацевтического продукта
- CTO
- Клетки, ткани, органы
- ДЕЛУ
- Лекарственное учреждение, лицензионная единица
- DIN
- Идентификационный номер лекарства
- DIN-HM
- Номер гомеопатического лекарства
- EDR
- Экстренная выдача лекарств
- EL
- Лицензия на учреждение
- ESC
- Свидетельство об экспериментальном исследовании
- FDR
- Положения о пищевых продуктах и лекарствах
- GMP
- Надлежащая производственная практика
- LOA
- Доверенность
- MCE
- Сертификат производителя на экспорт
- MDD
- Управление медицинского оборудования
- MDL
- Лицензия на медицинское оборудование
- MDEL
- Лицензия на производство медицинских изделий
- MDR
- Правила медицинского оборудования
- MRA
- Соглашение о взаимном признании
- NHP
- Натуральные продукты для здоровья
- NHPR
- Положения о натуральных продуктах здоровья
- NOA
- Уведомление о разрешении
- №
- Письмо об отсутствии возражений
- НПН
- Номер продукта Natural Health
- SAP
- Программа особого доступа
- TPD
- Управление терапевтических товаров
- VHP
- Ветеринарные товары для здоровья
Условия
Эти определения объясняют, как термины используются в этом документе.В случае противоречия с определениями, приведенными ниже, преимущественную силу имеет определение, содержащееся в Законе / Постановлении.
Активный ингредиент: означает лекарственное средство, которое при использовании в качестве сырья при производстве лекарственного средства в лекарственной форме обеспечивает желаемый эффект (Раздел 1A, Часть C, Положения о пищевых продуктах и лекарствах ).
Активный фармацевтический ингредиент (API): означает активный ингредиент, который используется при изготовлении фармацевтического препарата (Раздел 1A, Часть C, Положения о пищевых продуктах и лекарствах ).
Реклама: Включает любое представление любыми средствами с целью прямой или косвенной рекламы продажи или утилизации любых продуктов питания, лекарств, косметических средств или устройств.
Сельскохозяйственный имплантат: Продукт, который представлен в форме, подходящей для замедленного высвобождения активного ингредиента в течение определенного периода времени, и который предназначен для введения под кожу животного, производящего пищу, с целью увеличения веса. прирост и повышение эффективности кормления.Для целей C.01.045 (2) и C.01.046 Правил по пищевым продуктам и лекарствам сельскохозяйственный имплант считается лекарственной формой, не подходящей для использования человеком.
Коммерческий импорт: включает, но не ограничивается, отгрузку, предназначенную для розничного продавца, дистрибьютора или другого коммерческого предприятия. Сюда входят поставки, отправляемые независимым торговым подрядчикам / дистрибьюторам или практикующим специалистам для использования в их практике.
Устройство: Означает инструмент, аппарат, приспособление или другое подобное изделие или реагент in vitro, включая компонент, часть или принадлежность любого из них, который произведен, продан или представлен для использования в:
- диагностика, лечение, смягчение или предотвращение заболевания, расстройства или ненормального физического состояния или любого из их симптомов у людей или животных,
- восстановление, изменение или исправление строения тела людей или животных или функционирования любой части тела людей или животных,
- диагностика беременности у людей или животных,
- уход за людьми или животными во время беременности, во время или после рождения потомства, включая уход за потомством, или
- предотвращение зачатия у людей или животных;
, однако, он не включает такой инструмент, устройство, приспособление или изделие, или компонент, часть или аксессуар любого из них, которые совершают любое из действий, указанных в параграфах (a) — (e), исключительно фармакологическими, иммунологическими или метаболическими средствами или исключительно химическими средствами внутри или на теле человека или животного (Раздел 2 Закона).
Лекарственная форма: Окончательная физическая форма лекарственного препарата, которая может использоваться потребителем без необходимости какого-либо дальнейшего производства.
Лекарство: Включает любое вещество или смесь веществ, произведенных, проданных или представленных для использования в:
- диагностика, лечение, смягчение или предотвращение заболевания, расстройства или ненормального физического состояния или его симптомов у людей или животных:
- восстановление, исправление или изменение органических функций человека или животных: или
- дезинфекция помещений, в которых производится, готовится или хранится пища (статья 2 Закона).
Идентификационный номер лекарственного средства (DIN): Идентификационный номер лекарственного средства (DIN) — это восьмизначный цифровой код, присваиваемый Министерством здравоохранения Канады каждому лекарственному продукту, продаваемому в соответствии с Законом о пищевых продуктах и лекарствах и нормативными актами. Стандарт DIN однозначно определяет следующие характеристики продукта: производитель, торговая марка, лекарственный ингредиент (ингредиенты), концентрация лекарственных ингредиентов, фармацевтическая форма, способ применения.
Экстренный выпуск лекарств (EDR) для ветеринарных препаратов, недоступных в Канаде: Экстренный выпуск лекарств (EDR), через исключения, изложенные в C.08.010 и C.08.011 Закона о пищевых продуктах и лекарствах , разрешает практикующим врачам (т. Е. Тем, кто зарегистрирован и имеет право в соответствии с законами провинции или территории заниматься ветеринарной практикой), получать доступ к ветеринарным препаратам, которым не был предоставлен доступ к ветеринарным препаратам. разрешение на рынок в Канаде. Если разрешение будет предоставлено, Health Canada предоставит практикующему врачу «Разрешение на выдачу лекарств в экстренных случаях». Копию этого разрешения следует отправить вместе с грузом, чтобы обеспечить своевременный ввоз препарата в Канаду.
Регистрационный номер предприятия (для клеток, тканей и органов (CTO)): Шестизначный (6) цифровой код, начинающийся с единицы (1), присвоенный утвержденному учреждению в соответствии с правилом Безопасность человеческих клеток, тканей и органов для Положение о трансплантации .
Экспорт: Для целей данного руководства «экспорт» включает в себя, помимо отправки или транспортировки продукта для здоровья за границу, продажу или рекламу в Интернете продукта для здоровья в иностранную юрисдикцию.
Надлежащая производственная практика (GMP): В этом документе содержатся ссылки на требования части C, раздел 2 (Надлежащая производственная практика) Положения по пищевым продуктам и лекарствам и руководящие указания по толкованию по этому вопросу, опубликованные Министерством здравоохранения Канады.
Медицинское учреждение: Учреждение, предоставляющее пациентам диагностические или терапевтические услуги. Он включает группу таких объектов, которые подчиняются одному общему руководству, которое несет ответственность за деятельность, выполняемую на этих объектах.( Положение о медицинском оборудовании )
Специалисты в области здравоохранения: В эту группу входят врачи, стоматологи, фармацевты, ветеринары и другие специалисты в области здравоохранения, а также работники медицинских учреждений и больниц. Члены этой группы обычно регулируются своими профессиональными организациями и / или в соответствии с законодательством провинции / территории, хотя они также могут иметь обязательства в соответствии с Законом о пищевых продуктах и лекарствах и связанными с ним положениями.
Номер гомеопатического лекарства (DIN-HM): Это восьмизначный цифровой код, присваиваемый каждому гомеопатическому лекарству, утвержденному для продажи в соответствии с Регламентом по натуральным продуктам для здоровья .
Импорт: Для целей данного руководства «импорт» — это любое действие, в результате которого товар пересекает границу Канады из-за пределов Канады.
Разрешение на продажу: Юридический документ, выданный Министерством здравоохранения Канады, разрешающий продажу лекарственного средства или устройства в соответствии с требованиями к здоровью и безопасности Закона о пищевых продуктах и лекарствах и связанных с ним нормативных актов.Маркетинговое разрешение может быть в форме Уведомления о соответствии (NOC), идентификационного номера лекарства (DIN), лицензии на устройство для медицинских устройств классов II, III или IV, номера натурального продукта (NPN) или гомеопатического DIN (DIN). -HM).
Медицинское устройство: Любое устройство (см. Определение устройства выше) в значении Закона о пищевых продуктах и лекарствах , но не включает устройства, предназначенные для использования с животными.
Натуральный продукт для здоровья (NHP): Вещество, указанное в Приложении 1 Регламента по натуральным продуктам для здоровья , или комбинация веществ, в которой все лекарственные ингредиенты являются веществами, перечисленными в Приложении 1, i.е. гомеопатическое лекарство или традиционное лекарство, которое производится, продается или представлено для использования в:
- Диагностика, лечение, смягчение или предотвращение заболевания, расстройства или ненормального физического состояния или его симптомов у людей;
- Восстановление или коррекция органических функций человека; или
- Изменение органических функций человека, например изменение этих функций таким образом, чтобы поддерживать или укреплять здоровье.
Тем не менее, Натуральный продукт для здоровья не включает вещество, перечисленное в Приложении 2 Регламента по натуральным продуктам для здоровья , любую комбинацию веществ, которая включает вещество, перечисленное в Приложении 2, или лекарство (гомеопатическое или традиционное), которое является или включает вещество, указанное в Приложении 2.
Кроме того, в соответствии с подразделом 2 (2) NHPR, вещество или комбинация веществ или традиционная медицина не считается натуральным продуктом для здоровья, если его продажа в соответствии с Правилами по пищевым продуктам и лекарствам (FDR), при продаже требуется соблюдение предписания, кроме как в соответствии с разделом C.01.043 FDR.
Номер натурального продукта (NPN): Это восьмизначный цифровой код, присваиваемый каждому натуральному продукту для здоровья, утвержденному для продажи в соответствии с Регламентом по натуральным продуктам для здоровья .
Импорт для личного пользования: Относится к ввозу отдельным лицом для собственного использования или для человека / животного, находящегося под опекой или опекой этого лица, а не для дальнейшей продажи и обычно составляет менее 90 дней. Он не распространяется на практикующего врача (врача, ветеринара и т. Д.), Импортирующего лекарства для пациентов / животных, находящихся под их опекой, что считается коммерческим импортом.
Клинические испытания фазы IV: Все исследования, проведенные в рамках утвержденных показаний после того, как препарат был одобрен регулирующим органом для продажи.Эти исследования часто важны для оптимизации использования препарата. Они могут быть любого типа, но должны преследовать обоснованные научные цели. Обычно проводимые исследования включают исследования безопасности и исследования, предназначенные для поддержки использования по утвержденным показаниям (например, исследования смертности и заболеваемости или эпидемиологические исследования). (Руководство для спонсоров клинических испытаний: приложения для клинических испытаний)
Лекарство, отпускаемое по рецепту : Лекарственное средство, включенное в Список рецептурных препаратов, в который время от времени вносятся поправки, или препарат, который является частью указанного в нем класса препаратов.
Список рецептурных препаратов: Список, установленный министром в соответствии с разделом 29.1 Закона.
Продам: включает
- предложить для продажи, выставить на продажу или иметь в собственности для продажи — или передать одному или нескольким лицам, независимо от того, производится ли распределение за вознаграждение, и
- сдавать в аренду, предлагать в аренду, выставлять в аренду или владеть в аренду.
Отгрузка: Груз товаров от одного грузоотправителя, предназначенный импортеру, независимо от количества или количества контейнеров, упаковок или штук.
Программа специального доступа (SAP) для лекарств и медицинских устройств, недоступная в Канаде: Программа специального доступа (SAP), с исключениями, изложенными в C.08.010 и C.08.011 Правил по пищевым продуктам и лекарствам и части 2 Раздел 69-78 Регламента по медицинскому оборудованию позволяет врачам и стоматологам получать доступ к продуктам здравоохранения для использования людьми, которые не получили разрешения на продажу в Канаде. Решения о разрешении этих исключений основываются на обстоятельствах и деталях каждой ситуации.Если разрешение предоставлено, Министерство здравоохранения Канады предоставляет разрешение (LOA) производителю лекарственного средства или устройства, разрешающее его продажу запрашивающему практикующему врачу. Копия этого письма отправляется практикующему. Копия этого письма должна быть отправлена вместе с грузом, чтобы обеспечить своевременный ввоз лекарственного препарата / медицинского устройства в Канаду.
Источники (для CTO): Согласно правилам «Безопасность человеческих клеток, тканей и органов при трансплантации» это включает:
- с учетом пункта (b), в случае органа от умершего донора, соответствующая организация по донорству органов;
- в случае дополнительных сосудов, которые извлекаются вместе с органом и не используются сразу при трансплантации органа, соответствующий банк тканей;
- в случае органа от живого донора или лимфогематопоэтических клеток, которые не хранятся в банке, соответствующее учреждение по трансплантации;
- в случае тканей или банков лимфогематопоэтических клеток — соответствующий банк клеток или тканей; и
- в случае островковых клеток — учреждение, которое подготавливает клетки для использования в трансплантации.
Ветеринарный продукт для здоровья (VHP): лекарств низкого риска в лекарственной (готовой к применению) форме. Они используются для поддержания или улучшения здоровья и благополучия домашних и пищевых животных. Они не предназначены для лечения, предотвращения или лечения болезней. VHP должны производиться с использованием разрешенных веществ в соответствии с условиями, указанными в Списке C: Ветеринарные товары для здоровья.
Приложение B: Свяжитесь с нами
- Чтобы получить помощь в применении этих рекомендаций, обратитесь в Программу соблюдения пограничных требований в отношении товаров для здоровья:
Электронная почта: [email protected]
Телефон: 1-800-267-9675 - По вопросам о контролируемых веществах обращайтесь в Управление контролируемых веществ.
- Для получения информации о том, как получить идентификационный номер лекарства (DIN), обратитесь в Управление терапевтических продуктов (TPD):
Электронная почта: [email protected]
Телефон: 613-941-0827 - Для получения информации о том, как подать заявку на получение лицензии на создание лекарственных препаратов (DEL), обращайтесь в отдел лицензирования фармацевтических предприятий (DELU):
Электронная почта: [email protected]
Телефон: 613-618-4529
Телетайп: 1-800-465-7735 (Service Canada) - Для получения информации о том, как получить NPN, DIN-HM и / или SL, обратитесь в Управление по натуральным и безрецептурным продуктам для здоровья:
Электронная почта: [email protected]
Телефон: 613-960-8827
Для классификации вашего продукта свяжитесь с hc.ингредиент[email protected]. - Для получения информации о том, как подать заявку на лицензию на создание медицинского оборудования, обратитесь в Отдел соответствия и лицензирования медицинских устройств, Управление по медицинскому оборудованию и клиническому соответствию:
Электронная почта: [email protected]
Телефон: 613-954-6790 - Для получения информации о том, как подать заявку на лицензию на медицинское устройство или для классификации вашего продукта, обратитесь в Управление терапевтических продуктов (TPD):
Электронная почта: devicelicensing-homologationinstruments @ hc-sc.gc.ca
Телефон: 613-957-7285 - Для получения информации об особом доступе к лекарствам и товарам для здоровья обращайтесь в Программу особого доступа:
Электронная почта: [email protected]
Телефон: 613-941-2108 - Для получения информации о ветеринарных препаратах и / или ветеринарных товарах для здоровья обращайтесь в Управление ветеринарных препаратов:
Электронная почта: [email protected]
Телефон: 613-954-5687 - По вопросам, касающимся крови, спермы и CTO, обращайтесь в Программу соответствия биологическим продуктам:
Электронная почта: [email protected]
Телетайп: 1-800-465-7735
Для получения информации о регистрации учреждения технического директора обращайтесь по адресу [email protected].
Приложение C: Каталожные номера
Законы
Политические и руководящие документы
Бланки заявлений
Другое
Отдел фармацевтического контроля | дох
УВЕДОМЛЕНИЕ О ЗАДЕРЖКАХ ДОСТАВКИ DC Health испытывает задержки с доступностью почты из-за воздействия COVID-19 на почтовую службу США. Благодарим вас за терпение, поскольку мы продолжаем обрабатывать всю почту как можно быстрее. |
*** ОБНОВЛЕНИЯ COVID-19 ***
ОБНОВЛЕНО : Процессинговый центр Управления по регулированию и лицензированию здравоохранения (HRLA) полностью откроет свою стойку государственных услуг с понедельника по пятницу, начиная с 12 июля 2021 года, с 8:30 до 15:30 .
Рекомендации и передовой опыт по COVID-19
Для получения самой последней информации о реакции округа на COVID-19, включая информацию о передовых методах, отказах от лицензирования и рекомендуемых руководящих принципах, перейдите по адресу coronavirus.dc.gov .
В связи с постоянными усилиями по борьбе с распространением COVID-19, которые вступают в силу немедленно, Управление по регулированию и лицензированию здравоохранения (HRLA) внедряет политику 100% удаленной работы.
Физические лица также могут позвонить в Процессинговый центр по телефону 1 (877) 672-2174 , чтобы получить обновленную информацию о своем незавершенном заявлении.
В связи с продолжающейся пандемией COVID-19 все заседания Совета медицинских работников в настоящее время проводятся виртуально. Пожалуйста, проверьте соответствующий веб-сайт каждого совета, чтобы узнать, когда состоится следующее собрание.
Если вы уже связались со специалистом по лицензированию здравоохранения (HLS), отправьте любые документы в указанный HLS по электронной почте.
* Обновление почтового адреса отдела фармацевтического контроля *
ЭФФЕКТИВНО НЕМЕДЛЕННО заявителя должны подать все заявки на объект в офис отдела фармацевтического контроля, расположенный по адресу:
899 North Capitol Street, NE
Первый этаж
Вашингтон, округ Колумбия 20002
Заявки на объект включают:
- Новые и обновленные приложения DM (производитель, дистрибьютор, оптовый торговец)
- Заявки на регистрацию новых и продленных контролируемых веществ для объектов DM
- Заявки в новую аптеку
- Заявки на регистрацию новых контролируемых веществ для аптек
- Заявки на получение разрешения на новые и продленные слуховые аппараты.
* Продление лицензии на аптеку *
Отдел фармацевтического контроля продлевает период продления до среды, , 30 июня 2021 года . Это означает, что ваша лицензия на аптеку для резидентов или нерезидентов и регистрация контролируемых веществ не истекают до 30 июня 2021 года. Все заявки на продление необходимо подавать до 31 мая 2021 года, чтобы избежать штрафов за просрочку платежа. Заявка на продление доступна ТОЛЬКО ОНЛАЙН . Бумажные заявки не принимаются.
Отказ от лицензии
В ответ на COVID-19 DC Health отменила все лицензионные требования для практикующих врачей, имеющих хорошую репутацию в другой юрисдикции. Вы можете узнать больше о процессе отказа ЗДЕСЬ.
Если вам требуется помощь со стороны Управления фармацевтики / отдела фармацевтического контроля, пожалуйста, свяжитесь со следующими лицами по электронной почте:
Сервис | Персонал | Адрес электронной почты |
Лицензия / регистрация (фармацевт, стажер, фармацевт, техник) | г-жаКарин Бэррон Г-жа Луанн Гринуэй | [адрес электронной почты защищен] [адрес электронной почты защищен] |
Лицензирование производственного объекта / Регистрация контролируемых веществ (Аптеки-резиденты, Аптеки-нерезиденты, оптовая и розничная торговля) | Г-жа Бриттани Аллен | [адрес электронной почты защищен] |
(Новое) Регистрация контролируемых веществ для практикующих | г-жаКарин Бэррон Г-жа Луанн Гринуэй | [адрес электронной почты защищен] [адрес электронной почты защищен] |
(Продление) Практикующий специалист по регистрации контролируемых веществ | г-жа Карин Бэррон Г-жа Луанн Гринуэй | [адрес электронной почты защищен] [адрес электронной почты защищен] |
Подразделение
по контролю за фармацевтическими препаратами несет нормативную ответственность, которая включает ежегодные проверки лицензий, надзор и мониторинг деятельности на предприятиях, которые закупают, распространяют, отпускают и управляют предписанными / рецептурными продуктами для продажи или использования потребителям в округе Колумбия.Регулируемые объекты включают; аптеки, больницы, программы лечения наркозависимости, исследователи, местные оптовые торговцы, дистрибьюторы, учреждения длительного ухода, клиники для животных, диализные центры и амбулаторные хирургические центры.
Отдел фармацевтического контроля обеспечивает соблюдение всех окружных и федеральных законов и нормативных актов в отношении аптек (законы о фармацевтике, контролируемых веществах, замене рецептурных препаратов, чистоте лекарств, а также законы о распространении и производстве лекарств, а также соответствующие постановления и т. Д.).
Отдел фармацевтического контроля служит связующим звеном между правительством округа и федеральными агентствами, (т.е. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Управление по борьбе с наркотиками, Служба здравоохранения и социальных служб, Агентство по защите прав потребителей и т. Д.), Включая вопросы регулирующего контроля.
Отдел фармацевтического контроля проводит расследования и предоставляет консультации всем учреждениям и программам, которые предоставляют фармацевтические продукты и услуги жителям округа Колумбия.
Все жалобы, касающиеся отпуска, назначения, производства, распределения и оптовой продажи лекарств, расследуются Фармацевтическим контролем. Чтобы подать жалобу, заполните форму ниже.
База данных мониторинга контролируемых веществ (CSMD) и Закон о безопасности рецептов
Часто задаваемые вопросы
Закон о безопасности по рецепту и Закон TN вместе представляют собой значительные усилия Генеральной Ассамблеи по решению проблемы злоупотребления лекарствами, отпускаемыми по рецепту. Эти законы существенно изменили правила, касающиеся CSMD. Прежде чем назначать или отпускать опиоиды, обратитесь к разделу часто задаваемых вопросов TN Together для лиц, назначающих препараты, и фармацевтов на https: // www.tn.gov/opioids.html (щелкните «Вы медицинский работник?»), чтобы понять, когда код МКБ 10 или обнаружение медицинской необходимости может быть и / или должно быть добавлено к рецепту, чтобы понять, когда происходит частичное заполнение рецепта. разрешено по определенным рецептам на опиоиды.
Все практикующие врачи с номерами DEA, которые выписывают или отпускают контролируемые вещества в практике оказания непосредственной помощи пациентам в Теннесси более пятнадцати (15) дней в календарном году, должны быть зарегистрированы в CSMD.Лицензированные ветеринары, которые никогда не прописывают и не отпускают контролируемое вещество в количестве, предназначенном для лечения пациента, отличного от человека, в течение более пяти (5) дней, не требуются, но им рекомендуется зарегистрироваться. Жизненно важно, чтобы каждый регистрант предоставлял и поддерживал уникальный и действительный адрес электронной почты в CSMD, чтобы CSMD мог связываться с регистрантом для обеспечения постоянного доступа к базе данных.
Практикующие медицинские работники или лица, находящиеся под наблюдением и контролем практикующих врачей, фармацевтов или аптек, которые имеют законное право отпускать контролируемые вещества, указанные в таблицах II, III, IV или V, должны предоставить определенные данные в CSMD.
Закон разрешает практикующим специалистам назначать представителя (ранее называвшегося «расширитель») для проверки CSMD. Делегаты должны действовать под наблюдением лицензированного практикующего врача.
Эти часто задаваемые вопросы не являются исчерпывающими. Если у вас есть какие-либо вопросы относительно закона, касающегося CSMD, вы можете обратиться за помощью к юрисконсульту.
1. Когда мне нужно зарегистрироваться в CSMD?
Если требуется регистрация, как указано выше, практикующий врач, как назначающие, так и фармацевты, или их агенты должны зарегистрироваться в течение 30 дней с момента получения номера DEA или становления агентом практикующего врача с номером DEA.
2. Как зарегистрироваться для доступа к базе данных CSMD?
Перейдите на сайт www.tncsmd.com и щелкните слово «зарегистрироваться», чтобы начать процесс регистрации. Завершение процесса регистрации потребует определенных идентифицирующих элементов. После завершения и утверждения регистрации вы получите электронное письмо с вашим именем пользователя и инструкциями по созданию пароля. Роль судмедэкспертизы предоставляется только государственным медицинским экспертам.
3. Я не практикую и не живу в Теннесси, но вижу жителей Теннесси.Могу ли я зарегистрироваться для доступа к CSMD?
Да, если вы имеете право заниматься в TN и имеете право на регистрацию в TN, вы можете зарегистрироваться. В противном случае вам следует зарегистрироваться в PDMP своего штата, и TN имеет соглашения о совместном использовании с большинством штатов.
4. Каковы требования к моему паролю?
Первоначально система отправит вам электронное письмо со ссылкой для создания пароля. Требования к паролю:
- Пароли должны содержать не менее восьми (8) символов
- Одна заглавная буква алфавита
- Одна строчная буква алфавита
- Один цифровой символ
- Один специальный символ (ПРИМЕР: +, $,%)
- Не должен совпадать с вашим предыдущим паролем
5.Что произойдет, если я забуду свой пароль?
Если вы не можете войти в систему, вы можете выбрать «Забыли / сбросить пароль» и дать ответы на вопросы безопасности, которые вы выбрали при регистрации, или выбрать, чтобы система отправляла ссылку на электронную почту, содержащуюся в вашем «Моем аккаунте» / профиле пользователя в CSMD. Вы сможете создать новый пароль, используя один из двух предложенных вариантов. Если вы не можете создать новый пароль из этих двух вариантов, вам нужно будет отправить электронное письмо в [email protected]: или позвоните по телефону 615-253-1305 для получения помощи.
6. Что произойдет, если у меня нет водительских прав штата Теннесси?
Вы все еще можете зарегистрироваться на сайте www.tncsmd.com, но вам нужно будет получить удостоверение личности штата Теннесси. Вы введете идентификационный номер штата Теннесси в поле водительских прав при регистрации. Если у вас есть водительские права из другого штата, вы можете зарегистрироваться в CSMD, но это может потребовать ручной проверки командой CSMD.
7.Я уже зарегистрирован. Мне нужно что-то еще делать?
Для обеспечения доступа к системе вы всегда должны иметь уникальный активный адрес электронной почты . Не забудьте обновить свою учетную запись по мере необходимости, перейдя по ссылке «Моя учетная запись » после успешного входа на сайт www.tncsmd.com.
8. Как руководитель, как делегат регистрируется для запроса CSMD от моего имени?
Делегат начнет процесс с регистрации в CSMD на сайте www.tncsmd.com, выбрав соответствующую роль (лицензированный или нелицензированный практикующий врач-консультант, если вы работаете у врача, выписавшего рецепт, и фармацевт-медработник в аптеке). После выбора соответствующей роли делегат должен предоставить всю необходимую информацию. Чтобы связаться с практикующим врачом или фармацевтом, зарегистрированному лицу потребуется номер водительского удостоверения его руководителя. Когда этот номер добавлен, имя супервизора появится для выбора для добавления к регистрации.После того, как регистрация будет завершена автоматически или вручную, выбранный супервизор получит электронное письмо с сообщением о том, что медицинский консультант / делегат ожидает одобрения супервизора. Супервизор и / или медицинский консультант / делегат могут отозвать / деактивировать отношения в любое время, войдя в CSMD и перейдя в «Моя учетная запись», чтобы прекратить отношения.
9. Как супервизор я обязан активировать / деактивировать делегата, который добавил меня в качестве супервизора в свою учетную запись?
Супервизор будет получать электронное письмо каждый раз, когда представитель Health Care Extender / Delegate или APRN / PA добавляет этого пользователя в качестве супервизора, чтобы супервизор узнал о действии.Надзорный орган несет ответственность за вход в CSMD и утверждение или отмену надзорных отношений. В любой момент времени вы больше не контролируете пользователя CSMD в своей учетной записи, входите в CSMD и «неактивны / аннулируете» эти отношения, войдя в CSMD и перейдя в «Моя учетная запись».
10. Кто должен проверять CSMD?
Все практикующие врачи должны проводить проверку перед назначением опиоида или бензодиазепина пациенту в качестве нового эпизода лечения и каждые шесть (6) месяцев после этого, когда указанное контролируемое вещество остается частью лечения.Новый эпизод лечения означает рецепт на контролируемое вещество, которое не было прописано этим практикующим врачом в течение предыдущих шести (6) месяцев. Новый эпизод лечения включает в себя не только смену конкретных лекарств, но и все изменения силы назначенного лекарства и частоты его приема.
Все практикующие врачи также обязаны проверять, прежде чем назначать опиоид или бензодиазепин в качестве нового эпизода лечения пациенту-человеку в первый раз на этом месте практики и каждые шесть (6) месяцев после этого, когда указанное контролируемое вещество остается частью лечения. для этого пациента-человека после первоначальной выдачи.
Однако практикующие врачи не обязаны проверять, в соответствии с законом, если: (a) контролируемое вещество прописано или отпущено пациенту, который в настоящее время получает лечение в хосписе; (b) комитет определил, что практикующие врачи по определенной медицинской специальности не должны проводить проверки в результате низкого потенциала злоупотреблений со стороны пациентов, получающих лечение по этой медицинской специальности; (c) количество прописанного или отпущенного контролируемого вещества не превышает количества, достаточного для одного трехдневного периода лечения и не допускающего повторного введения; или (d) контролируемое вещество назначается для введения непосредственно пациенту во время курса стационарного или стационарного лечения в больнице или доме престарелых, лицензированных по разделу 68.
Перед назначением или отпуском врач также должен проверить базу данных, если практикующий врач осведомлен или обоснованно уверен в том, что человек пытается получить контролируемое вещество из Списка II-V, которое определено комитетом или комиссаром как демонстрирующее потенциальную возможность за злоупотребления, в мошеннических, незаконных или неуместных с медицинской точки зрения целях в нарушение § 53-11-402.
Представитель уполномоченного практикующего врача может проверить базу данных от имени практикующего врача.
Примечание: Для практикующих врачей может быть хорошей практикой регулярно проверять базу данных, чтобы вооружиться достаточной информацией для принятия решений относительно планов лечения, чтобы быть в курсе дозировок своих пациентов в миллиграммах морфина (MME), несколько поставщиков эпизодов и снизить риск побочных эффектов от назначения.
Лицензированные ветеринары не обязаны проверять базу данных перед назначением контролируемого вещества пациенту, не являющемуся человеком.Однако изменения в графике приема некоторых лекарств, в первую очередь габапентина, могут повлиять на требования, связанные с лечением пациентов, не являющихся людьми.
11. Кто может зарегистрироваться для доступа к базам данных?
Лицо, имеющее лицензию, зарегистрированное или имеющее иное разрешение выписывать, распространять или отпускать контролируемое вещество в ходе профессиональной практики.
Сертифицированная медсестра-анестезиолог (CRNA), как описано в Разделе 63-7-103 Аннотированного Кодекса Теннесси.Теннесси — один из первых штатов, разрешивших прямой доступ для CRNA без регистрации DEA.
Делегаты практикующих врачей могут зарегистрироваться с разрешения и под наблюдением практикующего врача.
Кроме того, закон позволяет ряду других государственных и федеральных должностных лиц регистрироваться в базе данных, включая некоторых сотрудников правоохранительных органов, медицинских экспертов, судей судов по наркотикам и других. Для получения дополнительной информации о такой регистрации обратитесь к Теннесси.Код Энн. § 53-10-306.
12. Что произойдет, если у практикующего врача нет электронного доступа к базе данных?
Закон требует, чтобы каждое физическое или юридическое лицо, работающее на объекте практики, где пациенту-человеку прописывается или отпускается контролируемое вещество, обеспечивало электронный доступ к базе данных в любое время, когда практикующий врач предоставляет медицинские услуги пациенту-человеку, потенциально получающему контролируемое вещество. Нарушение этого требования карается гражданским штрафом в размере не более ста долларов в день в отношении физического или юридического лица, управляющего местом практики; Штраф налагается только в том случае, если существует постоянная практика или практика отказа от предоставления электронного доступа к базе данных.
13. Как мне сообщить, что система не работает?
Отправьте электронное письмо на адрес [email protected] с как можно более подробной информацией, включая скриншоты с любыми сообщениями или ошибками, касающимися проблемы, и вашу прямую контактную информацию, или позвоните по телефону 615-253-1305.
14. Кто входит в состав Комитета CSMD?
Членами комитета являются:
Один из назначенных губернатором лицензированных членов каждого из следующих советов или комитетов по лицензированию профессиональных медицинских работников: (A) Совет медицинских экспертов; (B) Комиссия по остеопатическому исследованию; (C) Совет по стоматологии; (D) Совет педиатрических медицинских экспертов; (E) доска оптометрии; (F) Совет ветеринарно-медицинских экспертов; (G) совет медсестер; Комиссия судебно-медицинских экспертов для фельдшеров; и Аптечный совет; и один (1) из членов совета по фармацевтике и один (1) из членов совета медицинских экспертов, которые были назначены в эти советы для представления широкой общественности.Правления выбирают этих представителей.
15. Я практикующий врач. Могу ли я увидеть рецепты, выданные под моим номером DEA?
Да. Сначала наведите указатель мыши на вкладку «ЗАПРОС» на верхней панели навигации, а затем выберите «Самостоятельный поиск практикующего» из списка. Страница будет отображаться по умолчанию для вашего DEA. Выберите период времени, который вы хотите просмотреть, и нажмите «Просмотреть отчет». Будет произведен отчет обо всех выписанных рецептах, приписанных вашему DEA.У вас есть возможность экспортировать этот отчет в формате PDF для дальнейшего просмотра информации. Этот отчет также позволяет вам создать отчет для конкретного пациента за указанное время и просмотреть только рецепт, который вы выписали для этого пациента. Заполните информацию о пациенте и выберите «Просмотреть отчет», и вы сможете сохранить этот отчет в формате PDF для дальнейшего просмотра.
Если в вашем отчете есть рецепты, которые вам не принадлежат, обратитесь в аптеку, выдавшую рецепт, чтобы они могли оценить потенциальную подделку или исправить любые ошибки.Пожалуйста, подождите тридцать (30) дней после обращения в аптеку или к другому поставщику с просьбой исправить ошибку, чтобы дать время для внесения исправления в базу данных. По истечении тридцати (30) дней вы должны уведомить программу CSMD, если ошибка не была исправлена.
Если после разговора с аптекой будет выявлена мошенническая деятельность, пожалуйста, при необходимости сообщайте о любых мошеннических действиях пациента в местные правоохранительные органы.
16. Содержит ли CSMD механизм, позволяющий мне сравнивать прописываемые мной контролируемые вещества с таковыми у моих сверстников?
Да.На вкладке «Запрос» щелкните «Практик против коллег». По умолчанию система будет использовать предыдущий месяц, но вы можете изменить временные рамки с помощью раскрывающихся списков. Система покажет ваш ранг среди тех, кто работает по той же специальности, о которой вы сообщили в CSMD при регистрации. Этот рейтинг основан на общем количестве рецептов, выписанных за выбранный период времени.
17. Я лечащий врач. Как я могу просмотреть рецепты, выписанные моими подопечными?
На странице «Самостоятельный поиск практикующего» есть раскрывающийся список, в котором перечислены лица, назначающие супервизии, связанные с вашей учетной записью.Отсюда вы можете запустить отчет для выбранного супервизируемого или выбрать его для всех супервизируемых.
18. Как мне создать отчет для просмотра истории контролируемых веществ пациента?
После входа в CSMD в приложении появится пошаговая инструкция, щелкнув знак вопроса () на темно-синей полосе справа. Появятся текстовые инструкции, которые помогут вам выполнить запрос пациента. Наведите курсор на вкладку ЗАПРОС на верхней панели навигации.Затем выберите «Новый запрос», и появится страница с отчетом ПАЦИЕНТА по умолчанию. Введите ФАМИЛИЯ, ИМЯ и ФИО пациента (дату рождения). Прокрутите страницу вниз и найдите диапазон дат. По умолчанию используется прошлый год, но вы можете изменить это, установив флажок в поле и правильно введя даты (мм / дд / гггг). Вы должны выбрать желаемый тип вывода отчета: «PDF» или «XLS». Если вы хотите запросить другие состояния, чтобы определить, есть ли у вашего пациента данные, установите соответствующий флажок рядом с состояниями, а затем нажмите ОТПРАВИТЬ в самом низу страницы.
Система покажет вам индикатор (зеленое вращающееся колесо или панель задач в зависимости от вашего браузера) во время поиска в базе данных. Множественные данные состояния будут возвращены, если пользователь авторизован для просмотра данных другого состояния. После того, как панель задач исчезнет, в середине страницы появится экран со ссылкой «Отчет об истории болезни пациента». Щелкните по этой ссылке, и файл можно будет открыть или сохранить. Эта ссылка используется только при запуске данных на CSMD. Если вы запускаете отчет с несколькими состояниями, нажмите кнопку « Показать все результаты, », , а не в гиперссылке «Отчет об истории болезни пациента».
19. Могу ли я передать информацию, содержащуюся в CSMD, страховщику пациента?
Вы можете поделиться этой информацией. Если предоставленная информация содержится в медицинской карте пациента, а передача разрешена законом, она может быть передана стороннему плательщику. Закон о безопасности по рецепту от 2016 года прямо предусматривает, что отчеты CSMD могут быть помещены в медицинскую карту и что «[только что] после внесения в медицинские карты пациента [отчет CSMD] подлежит раскрытию на тех же условиях, что и медицинские записи.Теннеси. Код Энн. § 53-10-306 (h) (4).
Таким образом, в соответствии с Законом о безопасности по рецепту, юридически разрешено делиться отчетами CSMD, содержащимися в медицинской карте, при условии, что это совместное использование соответствует всем другим требованиям законодательства.
20. Требуются ли какие-либо действия, если я подозреваю, что пациент ходит за покупками к врачу, на основании просмотра его или ее записей?
Да, любой практикующий врач, который выписывает или отпускает контролируемые вещества, который действительно знает, что лицо сознательно, умышленно и с намерением обмануть, получить или попытаться получить контролируемое вещество, должен сообщить эту информацию в течение пяти (5) рабочих дней по адресу: местные правоохранительные органы.Форма для сообщения (отчет практикующего врача о потенциальном покупателе в правоохранительные органы) доступна по адресу: http://tn.gov/assets/entities/health/attachments/PH-4152.pdf
Позвоните в ближайшее правоохранительное учреждение и / или в Целевую группу по опасным наркотикам штата Теннесси по телефону 423-752-1479 или отправьте заполненную форму по факсу 423-267-8983.
Исключение: любой практикующий врач, который действительно знает, что человек сознательно, преднамеренно и с намерением обмануть, получить или попытаться получить контролируемое вещество и который лечит человека с психическим заболеванием, может, но не требуется, сообщать информацию сотрудникам правоохранительных органов.
21. Могу ли я просмотреть запросы, выполненные моими делегатами?
Да. Чтобы просмотреть запросы, выполненные делегатами, нажмите «Запрос», а затем «Просмотреть запрос», и вы найдете раскрывающееся окно со списком всех делегатов / расширителей, связанных с вашей регистрацией. Выберите делегата / расширителя и период времени, который вы хотите просмотреть, и вы сможете просмотреть все запросы, выполненные этим лицом в течение выбранного периода времени. Информация об этих делегатах / расширителях останется доступной для просмотра в течение контролируемого периода времени в тех случаях, когда вы больше не контролируете этого делегата / расширителя.
22. Как закон влияет на ветеринаров?
В то время как требования Закона о безопасности по рецепту обычно применимы к ветеринарам, Закон предусматривает, что лицензированные ветеринары, которые никогда не прописывают контролируемое вещество в количестве, предназначенном для лечения пациента, отличного от человека, в течение более пяти (5) дней, не обязаны зарегистрируйтесь в базе данных. Лицензированные ветеринары не обязаны проверять базу данных перед назначением опиоидов или бензодиазепинов пациенту, не являющемуся человеком.Более того, лицензированные ветеринары не обязаны сообщать в базу данных о выданных лекарствах, количество которых ограничено количеством, достаточным для лечения пациента, не являющегося человеком, в течение максимум пяти (5) дней.
23. Кто следит за базой данных о рецептурных лекарствах и как проводится этот мониторинг?
Мониторинг проводится персоналом Министерства здравоохранения штата Теннесси и контролируется Комитетом CSMD. Комитет стремится выявить необычные схемы назначения и отпуска контролируемых веществ, которые кажутся более высокими, чем обычно, с учетом конкретной специальности, обстоятельств, типа пациента или местонахождения практикующих врачей.
24. Если у меня есть общие вопросы или технические проблемы с базой данных, как их решить?
Приложение предоставляет визуальную справку на многих страницах при нажатии на синий вопросительный знак (), расположенный в правой части страницы. На многих страницах есть «Покажи мне», где видео продемонстрирует, как выполнить задачу, но некоторые будут содержать только текстовое описание того, как выполнить задачу. Администраторы CSMD доступны по электронной почте [email protected] или по телефону 615-253-1305.
25. Что делать, если практикующие врачи предпочитают игнорировать требования закона?
Несоблюдение требований законодательства CSMD может подвергнуть лицензиата дисциплинарному взысканию со стороны лицензионного совета. Кроме того, Закон о безопасности по рецепту от 2016 года допускает уголовное наказание при определенных обстоятельствах.
26. Если после просмотра информации, содержащейся в CSMD, я считаю, что расследование в отношении практикующего врача может быть целесообразным, как мне сообщить эту информацию в Департамент здравоохранения?
Форма жалобы доступна на веб-сайте жалоб.Форма для поставщиков медицинских услуг может быть отправлена в электронном виде или, если вы решите распечатать и заполнить форму, ее затем следует отправить в Управление расследований. Форма жалобы фармацевта или аптеки может быть распечатана, заполнена и отправлена в Аптечный совет.
27. Смогут ли практикующие врачи выяснить, какие контролируемые вещества могли ранее выдаваться из диспенсеров за пределами штата?
Во многих случаях да. Министерство здравоохранения штата Теннесси уполномочено заключать соглашения с другими штатами или другими организациями, действующими от имени штата, в целях обмена и распространения данных и информации в базе данных с 1 января 2013 года.Когда соглашения будут заключены, пользователи будут иметь возможность просматривать данные других состояний, установив соответствующие флажки в нижней части экрана запроса пациента. В настоящее время Министерство здравоохранения Теннесси имеет соглашения об обмене данными с Алабамой, Аризоной, Арканзасом, Делавэром, Флоридой, Джорджией, Иллинойсом, Индианой, Айовой, Кентукки, Луизианой, Мэн, Массачусетс, Мичиган, Миннесота, Миссисипи, Невада, Северная Каролина. , Северная Дакота, Огайо, Оклахома, Пенсильвания, Род-Айленд, Южная Каролина, Южная Дакота, Техас, Вирджиния, Западная Вирджиния, Висконсин и односторонний обмен данными (позволяющий Теннесси получать данные) с Мэрилендом, Системой военного здравоохранения и Санкт-ПетербургПрограмма мониторинга рецептов округа Луис
Обратите внимание, включение дополнительных состояний в создаваемые вами отчеты может увеличить время отклика или, в некоторых случаях, тайм-аут, поскольку TN не контролирует время отклика из других состояний. Кроме того, имейте в виду, что в каждом связанном штате действуют разные законы в отношении того, какие роли имеют доступ и как использовать информацию о мониторинге рецептов.
28. Требуется ли администрация по делам ветеранов или военный врач для проверки базы данных?
Закон штата Теннесси требует, чтобы все лица, назначающие препараты, назначающие контролируемые вещества и оказывающие непосредственную помощь пациентам в Теннесси в течение более 15 календарных дней в году, регистрировались в базе данных.Кроме того, закон Теннесси требует, чтобы практически все лица, назначающие опиоиды или бензодиазепины, регистрировались в базе данных. Однако федеральный закон может отменять любые такие требования. Таким образом, если закон штата и федеральный закон противоречат друг другу, применимый федеральный закон будет иметь преимущественную силу.
Чтобы зарегистрироваться, перейдите на http://www.tncsmd.com и выберите Практик из типа работы и введите всю необходимую информацию.
29. Должен ли я вручную вводить назначенный мне идентификатор входа каждый раз, когда я вхожу в CSMD?
Отдельный пользователь может изменить настройки своего интернет-браузера, чтобы разрешить сохранение назначенного им логина в куки-файлах браузера.Если вы выбрали сохранение назначенного им идентификатора входа в файл cookie, поле «Имя пользователя» будет автоматически заполнено назначенным им идентификатором входа. Для получения помощи обратитесь в свой отдел информационных технологий. Каждый пользователь несет ответственность за сохранение конфиденциальности своего имени пользователя и пароля.
30. Какие браузеры совместимы с CSMD?
Следующие браузеры обеспечивают наилучшую производительность с CSMD: Firefox, Google Chrome, Internet Explorer 11.9 или выше, Microsoft Edge и Safari.
31. Как мне уведомить CSMD о моих надзорных отношениях?
ПользователиAPRN и PA должны идентифицировать всех контролеров (имеющих отношение к назначению контролируемых веществ) в CSMD, введя номер водительского удостоверения контролера. Для текущих зарегистрированных пользователей нажмите «Моя учетная запись», чтобы обновить эту информацию.
На экране «Моя учетная запись» прокрутите вниз до раздела «Отношения с супервизором». Появятся существующие супервизоры, о которых уже сообщили CSMD, и для добавления дополнительных супервизоров пользователи могут просто ввести номер водительского удостоверения и статус выдачи и нажать кнопку «Добавить».Нажмите « Сохранить» внизу страницы, чтобы сохранить изменения, и пользователь получит сообщение об успешном внесении изменений.
Для новых надзорных отношений, которые связаны с местом практики, которого еще нет в их «Моей учетной записи», пользователи должны будут добавить данные о местонахождении практики, а затем могут добавить номер водительского удостоверения супервизора и статус выдачи. Появится всплывающее окно с местоположениями практик, связанных с этим контролирующим регистрантом, и супервизируемый должен выбрать соответствующее местоположение или местоположения и щелкнуть «Добавить выбранного поставщика».Это должно вернуть пользователя к экрану «Моя учетная запись». Нажмите « Сохранить » внизу страницы, чтобы сохранить изменения, и пользователь получит сообщение об успешном внесении изменений.
Наблюдающий врач, связанный с этим номером водительского удостоверения, будет уведомлен по электронной почте, а также при следующем входе в CSMD, когда делегаты ожидают утверждения. Затем наблюдающий врач может перейти к экрану «Моя учетная запись», на котором будут перечислены все ранее утвержденные, а также ожидающие отношения отношения с делегатами.Нажмите «Утвердить», чтобы принять отношения супервизора, и статус взаимоотношений супервизора / делегата будет отображаться как «Активно» как для супервизора, так и для APRN или PA.
Если соглашение о взаимоотношениях с супервизором расторгнуто, супервизор или APRN / PA могут щелкнуть «Неактивно / Отозвать» на экране «Моя учетная запись». В это время супервизор или делегат, которые «деактивированы / отозваны», будут уведомлены о действиях по прекращению супервизионных отношений.
Уведомление об изменениях в отношениях надзора через CSMD не отменяет требования со стороны APRN или PA подавать соответствующие формы в ваш лицензионный совет.
32. Если у меня несколько супервизоров, нужно ли мне обновлять мою регистрацию CSMD, добавляя номер водительского удостоверения каждого супервизора?
Да. APRN и PA должны сообщать обо всех надзорных органах (связанных с назначением контролируемых веществ), которые осуществляют надзор, контролируют и несут ответственность за предписывающие услуги этого APRN / PA или для которых этот APRN / PA может выполнять запросы CSMD. Экран «Моя учетная запись» позволяет вам добавить столько супервизоров, сколько необходимо.
33.Что произойдет, если у моего руководителя нет водительских прав?
Как указано в вопросе № 6 выше, для регистрации пользователей, не имеющих водительских прав, необходимо получить идентификатор штата Теннесси и ввести этот номер в поле «Водительское удостоверение» при регистрации. Супервизор может предоставить супервизируемому идентификационный номер штата Теннесси, чтобы позволить супервизируемому установить связь с супервизией в CSMD.
34. Как перемещаться между CSMD и сайтом сбора данных?
В правой части строки меню есть кнопка, которая позволяет легко переходить от CSMD к сайту сбора данных для диспенсеров.Информация о сборе данных приведена ниже.
35. Является ли габапентин контролируемым веществом в Теннесси и требует ли DEA для его назначения?
Габапентин является контролируемым веществом Списка V в Теннесси, и поэтому с ним следует обращаться так же, как и с любым другим контролируемым веществом Списка V.
СБОР ДАННЫХ О ДИСПЕНСЕРЕ: Чтобы соответствовать законодательным требованиям, лица, отпускающие по рецепту контролируемые вещества, должны будут убедиться, что их аптечная система выдачи соответствует ASAP 4.2A (версия от июня 2017 г.). Новые поля в ASAP 4.2A (версия от июня 2017 г.) позволят месту выдачи соответствовать требованиям законодательства.
Медицинская необходимость
Комитет CSMD определил в ASAP 4.2A (версия от июня 2017 г.), что тип лечения DSP24, который является ситуационным полем, будет использоваться для сообщения «Медицинская необходимость». Когда от врача, выписывающего рецепт, требуется написать на рецепте «Медицинская необходимость», то дозатор должен предоставить код в сбор данных TN.Поле типа лечения DSP24 с вводом 99 будет использоваться, чтобы указать, что в рецепте была указана «медицинская необходимость». По мнению практикующего врача, компании-разработчики программного обеспечения могут предоставить возможность указывать «медицинскую необходимость» в своем программном обеспечении без визуального отображения имени поля как можно скорее.
Код МКБ-10
Когда лицо, выписывающее рецепт, помещает код ICD-10 в рецепт, фармацевт должен передать код ICD-10 в систему сбора данных TN. Код диагностики DSP25 — ситуационное поле, доступное в ASAP 4.2A (версия от июня 2017 г.). будет использоваться. Это поле будет заполнено только в том случае, если код МКБ-10 указан в рецепте и не содержит дефисов, тире или точек.
Частичное заполнение
Новый формат ASAP 4.2A (версия от июня 2017 г.) позволит распределительному пункту сообщать пациенту о частичном заполнении, используя DSP13 (Индикатор частичного заполнения), а в дополнение к сообщению выданного количества используйте DSP22 (Предписанное количество) для большей ясности.
Команда CSMD обновила Руководство по сбору данных, и оно было размещено на веб-сайте CSMD: http: // www.tn.gov/health/csmd. Существует раздел руководства по сбору данных TN, содержащий руководство, а также другую полезную информацию.
1. Кто должен регистрироваться, чтобы сообщать о выплатах в CSMD?
Все практикующие врачи, аптеки, больницы и другие учреждения, имеющие лицензии, зарегистрированные или иным образом получившие разрешение на распространение или отпуск контролируемых веществ в ходе профессиональной практики в TN.
2. Должны ли все отчеты о выдаче подаваться в электронном виде?
Как правило, все отчеты о выдаче должны подаваться в электронном виде.Однако, если подача отчетов в электронном виде представляет собой неоправданные трудности, комитет может отказаться от требований к электронной отчетности на срок до двух лет. Щелкните здесь, чтобы получить доступ к форме запроса на отказ. В таких случаях по-прежнему требуется ручная отчетность.
3. Каковы требования к отчетности в базе данных и есть ли исключения для передачи информации в базу данных?
Любая аптека или лицензированный практикующий врач, имеющий номер DEA и распределяющий контролируемые вещества в (или в) Теннесси, должен сообщать в базу данных ежедневно (но не позднее закрытия рабочего дня следующего рабочего дня) каждое контролируемое вещество, которое у них есть. выдано за последние двадцать четыре (24) часа.Если практикующий лечащий врач не выписывает рецепты по Приложению II-V в течение отчетного периода, в базу данных должен быть отправлен «нулевой отчет». За подробностями обращайтесь к Руководству по сбору данных из базы данных контролируемых веществ штата Теннесси.
Ветеринары должны подавать рецепты только каждые четырнадцать (14) дней.
Диспенсеры не должны сообщать, если:
· Препарат вводят непосредственно пациенту.
· Препарат является частью программы лечения наркозависимости (например,g., программа лечения метадоном), зарегистрированная Управлением по борьбе с наркотиками США, и подлежит учету в соответствии с положениями 21 CFR 1304.24.
· Препарат отпускается в лицензированном медицинском учреждении при условии, что количество ограничено до количества, достаточного для лечения пациента в течение максимум 48 часов.
· Препарат представляет собой дополнительную упаковку лекарственных препаратов, помеченных как образец лекарства или дополнительное лекарство, распространяемое среди собственных пациентов практикующего врача, достаточное для лечения пациента в течение не более сорока восьми (48) часов в обычном процессе практики без выплата вознаграждения или вознаграждения любого рода.
· Препарат представляет собой образец контролируемого вещества из списка IV или V. Для исключения из отчетности образец препарата Списка IV должен быть в количестве, ограниченном до количества, достаточного для лечения пациента в течение максимум семидесяти двух (72) часов. Для исключения из отчетности образец препарата Списка V должен быть в количестве, ограниченном до количества, достаточного для лечения пациента в течение максимум четырнадцати (14) дней.
· Препарат отпускает лицензированный ветеринар при условии, что количество ограничено количеством, достаточным для лечения пациента, не являющегося человеком, в течение максимум пяти (5) дней.
4. Почему меня иногда просят позвонить в Апприсс?
Appriss собирает все загружаемые данные о рецептах от имени TN, поэтому, если вы являетесь аптекой или врачом, отпускающим контролируемые вещества, вы должны загрузить информацию о рецептах. Если у вас возникнут проблемы с загрузкой данных о рецептах, позвоните в Appriss по телефону: 1-866-683-9771 или обратитесь в службу поддержки: https://tnrxreport.zendesk.com/hc/en-us/requests/new. Центр загрузки находится по адресу: https: // www.tnrxreport.com
5. Что мне делать, если у меня возникают проблемы с загрузкой данных о моих рецептах?
Appriss имеет контракт на оказание поддержки клиентам, чтобы помочь фармацевтам или лицам, выписывающим лекарства, разрешить любые технические проблемы с загрузкой рецептов. Свяжитесь с Appriss по телефону: 866-683-9771 или обратитесь в службу поддержки: https://tnrxreport.zendesk.com/hc/en-us/requests/new.
6. Как я могу убедиться, что мой файл был успешно загружен и принят на Портал сбора данных Теннесси?
Практикующие медицинские работники, осуществляющие отпуск, несут твердое обязательство гарантировать, что их отчеты будут приняты независимо от метода, которым они были представлены.
Подача рецептов софтверной компании или центрального поставщика
а. Вы и центральный отправитель или компания-разработчик программного обеспечения будете получать автоматические уведомления по электронной почте после того, как ваш файл будет обработан (только если была предоставлена информация в следующем разделе b.)
г. Чтобы получать уведомления, связанные с номером DEA, лицо, ответственное за исправление ошибок, должно предоставить контактную информацию центральному отправителю или владельцу учетной записи компании-разработчика программного обеспечения в сборе данных.
Физическое лицо подает собственные рецепты
а. Вы получите автоматические уведомления по электронной почте после обработки вашего файла
г. Для получения уведомлений необходимо ввести контактную информацию в подробном разделе DEA вашего профиля пользователя.
Центральный репортер или компания-разработчик программного обеспечения посетят страницу Моя учетная запись на портале сбора данных и введут информацию, предоставленную уполномоченным лицом владельца DEA, чтобы убедиться, что в профиле есть уникальный активный адрес электронной почты для отправителя и каждый номер DEA, который отправитель подает от имени этого номера DEA.После обработки файла, если вся информация обновлена в приложении для сбора данных, отправитель и лицо, связанное с каждым DEA по выдаче, получат электронное письмо с информацией о загрузке файла и ссылкой на портал сбора данных, чтобы оба лица могли просмотреть любой выявленные ошибки в файле или записи. В ваше программное обеспечение можно внести соответствующие исправления, а затем отправить исправление. Уникальный активный адрес электронной почты для учетной записи и каждого DEA, если есть центральный отправитель или отправитель программного обеспечения, имеет решающее значение для обеспечения того, чтобы сообщения, касающиеся загрузок или любых изменений в требованиях к отчетности, были получены отправителем и лицом, связанным с DEA.Предпочтительный метод состоит в том, чтобы исправить информацию о рецепте в программном обеспечении и отправить исправленную версию, если в Tennessee Data Collection отправляются электронные заявки.
Вы можете проверить статус любого файла в любое время, войдя в портал сбора данных и выбрав Центр данных / Загрузка файла. На этой странице будут перечислены загруженные файлы, связанные с вашим номером DEA, или в качестве центрального отправителя будут указаны все номера DEA, отправленные учетной записью, а также статус файла и количество выявленных ошибок в файле или записи.Если электронная коррекция невозможна, то можно внести коррекцию вручную. Чтобы исправить выявленные ошибки, щелкните имя файла, при котором будет загружена страница ошибок загрузки файлов. После загрузки страницы ошибок загрузки файлов щелкните описание ошибки и найдите значок, похожий на лист бумаги (щелчок, который позволит отправителю исправить данные в Интернете). Вы можете повторить этот сценарий исправления данных для каждой обнаруженной ошибки.
7. Как загрузить данные в CSMD?
Информацию о выдаче рецептов можно получить в Appriss по телефону 866-683-9771 или в Руководстве по сбору данных штата Теннесси.Вы также можете связаться с Appriss по электронной почте с просьбой помочь с загрузкой данных по адресу https://tnrxreport.zendesk.com/hc/en-us/requests/new
.8. Должен ли я сообщать о габапентине в CSMD?
Да, габапентин является контролируемым веществом Списка V в Теннесси, и о нем следует сообщить в CSMD.
ПРИМЕЧАНИЕ: Вышеупомянутые часто задаваемые вопросы и ответы не отменяют положения закона, регулирующего CSMD, а просто предоставляются в качестве руководства для целей реализации и обеспечения соблюдения.Это добросовестные усилия Министерства здравоохранения штата Теннесси, направленные на обеспечение максимальной прозрачности при выполнении своей регулирующей роли. Вопросы носят информационный характер и не являются юридической консультацией. Более того, вопросы и ответы могут быть изменены. Тем, кто подпадают или могут подпадать под действие этих законов, настоятельно рекомендуется ознакомиться с применимыми законами и правилами и при необходимости обратиться за помощью к своему юристу. Ни TDH, ни органы здравоохранения не связаны этим руководством при толковании закона, потому что каждая ситуация уникальна.При создании этих часто задаваемых вопросов консультировались с медицинскими работниками и специалистами общественного здравоохранения, и департамент благодарит их за их роль, признавая при этом свою исключительную ответственность за ответы на часто задаваемые вопросы.