§ 8. Банковский перевод и документарный аккредитив / КонсультантПлюс
§ 8. Банковский перевод и документарный аккредитив
101. Платежи по претензиям по количеству, качеству, штрафам и из других оснований в расчетах между внешнеторговыми и другими организациями стран — членов СЭВ могут производиться в форме непосредственного перевода должником кредитору соответствующих сумм в переводных рублях.
102. Порядок расчетов в форме банковского перевода в переводных рублях регулируется межбанковскими соглашениями, инструкцией МБЭС о порядке расчетов в переводных рублях и настоящей Инструкцией.
103. Платежи в форме банковского перевода производятся по поручению плательщика (перевододателя).
Банк плательщика на основании заявления перевододателя направляет МБЭС по почте или по телеграфу (телексу) платежное поручение; копия поручения направляется банку переводополучателя. МБЭС на основании надлежаще оформленного платежного поручения списывает сумму перевода с текущего счета банка перевододателя и зачисляет ее на текущий счет банка переводополучателя.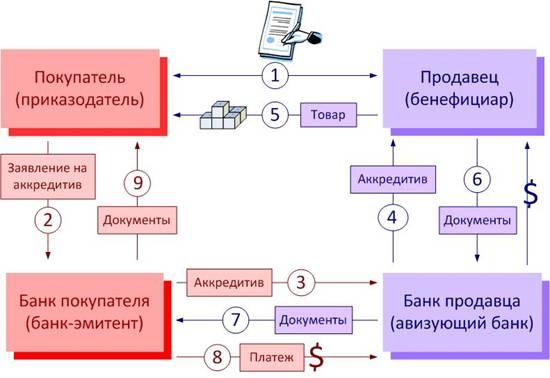
В кредитовом авизо банку переводополучателя указываются: номер и дата поручения банка перевододателя, наименование перевододателя и его банка, наименование переводополучателя, сумма и цель перевода. В дебетовом авизо указываются: дата, номер и сумма поручения.
104. В/О «Союзрасчетэкспорт» по получении кредитового авизо МБЭС зачисляет эквивалент суммы перевода в переводных рублях на соответствующие счета советских организаций в установленном настоящей Инструкцией порядке (п. п. 69, 70).
В случае, если в кредитовом авизо МБЭС не указано наименование перевододателя или переводополучателя или цель перевода, переводное поручение исполняется на основании соответствующих данных, содержащих в копии платежного поручения банка перевододателя.
105. В/О «Союзрасчетимпорт» выполняет заявление на перевод от внешнеторговых и других советских организаций в пользу организаций стран — членов СЭВ в установленном настоящей Инструкцией порядке (глава IV, раздел 4), с учетом нижеследующих положений:
а) платежное поручение направляется МБЭС в 2 экземплярах (04068573). При этом платежные поручения по возможности объединяются по каждому банку переводополучателя в сводное платежное поручение;
При этом платежные поручения по возможности объединяются по каждому банку переводополучателя в сводное платежное поручение;
б) при возврате экспортной выручки, ранее полученной по платежному требованию, внешнеторговая организация должна указывать конкретную причину возврата экспортной выручки. В случае, если возврат экспортной выручки производится в связи с непоставкой товара, двойной оплатой товара или услуг или переадресовкой товара покупателю другой страны, в заявлении на перевод советской организации должны быть дополнительно указаны: дата зачисления средств на счет организации при оплате платежного требования, номер платежного требования и символ операции.
106. Порядок расчетов в переводных рублях между внешнеторговыми организациями стран — членов СЭВ в форме документарного аккредитива производится в соответствии с действующими Унифицированными правилами и обычаями для документарных аккредитивов Международной торговой палаты, инструкцией МБЭС о порядке расчетов в переводных рублях и настоящей Инструкцией (глава IV, раздел 2).
Открыть полный текст документа
%d0%bf%d0%b5%d1%80%d0%b5%d0%b2%d0%be%d0%b4%d0%bd%d0%be%d0%b9%20%d0%b0%d0%ba%d0%ba%d1%80%d0%b5%d0%b4%d0%b8%d1%82%d0%b8%d0%b2 — с русского на все языки
Все языкиРусскийАнглийскийИспанский────────Айнский языкАканАлбанскийАлтайскийАрабскийАрагонскийАрмянскийАрумынскийАстурийскийАфрикаансБагобоБаскскийБашкирскийБелорусскийБолгарскийБурятскийВаллийскийВарайскийВенгерскийВепсскийВерхнелужицкийВьетнамскийГаитянскийГреческийГрузинскийГуараниГэльскийДатскийДолганскийДревнерусский языкИвритИдишИнгушскийИндонезийскийИнупиакИрландскийИсландскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКиргизскийКитайскийКлингонскийКомиКомиКорейскийКриКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛюксембургскийМайяМакедонскийМалайскийМаньчжурскийМаориМарийскийМикенскийМокшанскийМонгольскийНауатльНемецкийНидерландскийНогайскийНорвежскийОрокскийОсетинскийОсманскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийРумынский, МолдавскийСанскритСеверносаамскийСербскийСефардскийСилезскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТатарскийТвиТибетскийТофаларскийТувинскийТурецкийТуркменскийУдмурдскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧеркесскийЧерокиЧеченскийЧешскийЧувашскийШайенскогоШведскийШорскийШумерскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЮпийскийЯкутскийЯпонский
Все языкиРусскийАнглийскийИспанский────────АлтайскийАрабскийАрмянскийБаскскийБашкирскийБелорусскийВенгерскийВепсскийВодскийГреческийДатскийИвритИдишИжорскийИнгушскийИндонезийскийИсландскийИтальянскийКазахскийКарачаевскийКитайскийКорейскийКрымскотатарскийКумыкскийЛатинскийЛатышскийЛитовскийМарийскийМокшанскийМонгольскийНемецкийНидерландскийНорвежскийОсетинскийПерсидскийПольскийПортугальскийСловацкийСловенскийСуахилиТаджикскийТайскийТатарскийТурецкийТуркменскийУдмурдскийУзбекскийУйгурскийУкраинскийУрумскийФинскийФранцузскийЦерковнославянский (Старославянский)ЧеченскийЧешскийЧувашскийШведскийШорскийЭвенкийскийЭрзянскийЭсперантоЭстонскийЯкутскийЯпонский
| |||||
| ✎ New thread | Private message | Name | Date | |||
| 12.2021 0:22:45″>7 | 49 | proof | Bill Board1 | 7.12.2021 | 23:03 |
| 7 | 144 | Названия концертов | Tae_tae | 7.12.2021 | 15:58 |
| 17 | Расслышать слова в видео британский английский | Jerk | 6.12.2021 | 19:10 | |
| 8 | 138 | «кто о чём» | arthastrasza | 7.12.2021 | 14:08 |
| 12.2021 16:05:07″>3 | 133 | Расшифровка аббревиатуры WOT | Елена9364 | 7.12.2021 | 10:43 |
| 3 | 208 | Прошу проверить мой перевод | finance | 6.12.2021 | 18:47 |
| 64 | 1395 | Транскрипция | 1 2 all | aksa | 12.11.2021 | 23:21 |
| 6 | Circular run-out tot. max | anyaiulya | 7. 12.2021 12.2021 |
11:47 | |
| 21 | 649 | Где послушать произношение | Susan | 19.11.2021 | 14:07 |
| 10 | 239 | Найти синонимы | Destiny5562 | 5.12.2021 | 23:36 |
| 600 | 19173 | Проблемы в работе нового сайта | 1 2 3 4 5 6 7 8 9 10 11 12 13 all | 4uzhoj | 15.05.2019 | 11:05 |
| 1 | 256 | Просто классный ролик — посмеяться на выходные | niccolo | 4. |
23:16 |
| 6 | 384 | OFF: Стрижка «под Канадку». | Alex1888 | 1.12.2021 | 14:31 |
| 2 | 100 | Инструменты и термины ортопедии | Plavunez | 5.12.2021 | 23:14 |
| 6 | 151 | shin washer | ochernen | 5.12.2021 | 0:56 |
| 3 | 183 | Waiver | LordBEleth | 1. 12.2021 12.2021 |
21:30 |
| 4 | 145 | Ордер адвоката | Garbuziabr | 1.12.2021 | 22:43 |
| 4 | 96 | Radial/Anti-Radial | adelaida | 4.12.2021 | 0:42 |
| 14 | 226 | Carrington elevators | ochernen | 2.12.2021 | 11:27 |
| 126 | Свидетельство о браке | Larisochka | 3.12.2021 | 19:29 | |
| 4 | 12.2021 18:51:05″>115 | Помогите перевести / OSA Original Side Appeal , CMP Civil Miscellaneous Petition | fddhhdot | 3.12.2021 | 18:13 |
| 7 | 114 | services implement specifications | Miche | 3.12.2021 | 12:53 |
| 1 | 67 | «Spin-down» в анализаторе ДНК, РНК и протеинов | Greenbird | 3.12.2021 | 16:57 |
| 1 | 122 | Помощь | Андрес | 3.12.2021 | 13:26 |
| 12.2021 12:15:44″>9 | 229 | Что такое thread shave? резьба | stein_vik | 1.12.2021 | 12:44 |
| 2 | 104 | Справка о наследстве | fontana | 3.12.2021 | 8:28 |
LC | Lingual Consultancy
В эту эпоху глобализации каждый хочет глобализировать свои продукты и услуги, и поскольку у нас есть много разных стран, говорящих на разных языках. Итак, чтобы сделать вещи глобальными, нам нужно полагаться на перевод. Выбор переводчика онлайн имеет ряд преимуществ; тем не менее, это способствует различным потребностям проекта. Согласно проекту, мы должны выбрать нашего переводчика, потому что он предоставляет формат проекта, необходимые языки и страны назначения. В идеале переводчики обязательно должны быть носителями языка. Но если это не так, то они должны быть опытным профессионалом. В связи с этим мы должны выбрать лучшего переводчика для нашего перевода. Таким образом, нам необходимо выбрать лучшего переводчика для нашего перевода.
В идеале переводчики обязательно должны быть носителями языка. Но если это не так, то они должны быть опытным профессионалом. В связи с этим мы должны выбрать лучшего переводчика для нашего перевода. Таким образом, нам необходимо выбрать лучшего переводчика для нашего перевода.
В LC мы сохраняем прозрачность в отношениях с нашими клиентами. Итак, вот процесс перевода, благодаря которому мы день за днем добиваемся успеха:
- Запрос цены от клиента: На этом самом первом этапе мы получаем запрос цены от клиента для их проекта, в котором клиент упоминает свои требования и спрашивает о своих запросах.
- Отправлено ценовое предложение: Переходя к следующему шагу, мы отправляем ценовое предложение для конкретного проекта.
- Подтверждение клиента: Если клиент удовлетворен (что бывает в большинстве случаев) ценой, он отправляет нам подтверждение.
- Менеджер проекта Назначено: На этом шаге после всех подтверждений проект назначается менеджеру проекта для дальнейшего процесса.

- Задача, назначенная первому транслятору, зависящему от домена: На этом этапе относительно назначенный руководитель проекта назначает проект транслятору, зависящему от предметной области, для дальнейшего перевода в соответствии с требованиями.
- Задача, назначенная транслятору, зависящему от второго домена: После завершения работы по переводу проект назначается транслятору, зависящему от второго домена, т.е. для редактирования.
- Окончательная проверка менеджером: Затем проект возвращается в руки менеджера проекта для окончательной проверки.В случае каких-либо изменений переведенный документ повторно отправляется второму специализированному переводчику домена для внесения изменений в соответствии с требованиями клиента.
- Документ отправлен клиенту: И после завершения проекта, наконец, переведенный проект отправляется клиенту.

безотзывный аккредитив — Перевод на китайский — примеры английский
Эти примеры могут содержать грубые слова, основанные на вашем поиске.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
Безотзывный аккредитив от финансового учреждения с федеральной страховкой;
Программные мероприятия и расходы утверждаются и реализуются при наличии средств, т.е. наличных средств или безотзывного аккредитива .
方案活动和费用应根据资金到位情况,即现有资金或 不可撤销信用证 情况,予以核准和执行。We usually accept payment by irrevocable letter of credit payable against shipping documents.
In pursuance of the contract, the buyer issued an irrevocable letter of credit , but the seller failed to deliver the goods.
Условия оплаты, которые мы хотим принять, подтверждены и безотзывный аккредитив .
Оплата безотзывным аккредитивом нам удобна и мы выставим счет 60 д / с в вашем банке.
Оплата покупки должна быть произведена безотзывным аккредитивом в нашу пользу с оплатой векселем в фунтах стерлингов в Лондоне по предъявлении.
采购付款以我方为受益人 不可撤消信用证 有效,在伦敦以即期汇票英磅货币支付well, Mr Schmidt, you must be aware that an irrevocable letter of credit gives the exporter the additional protection of the banker’s guarantee
Our usual terms of payment are by confirmed, irrevocable letter of credit in our favour, reaching us one month ahead of shipment.
An irrevocable letter of credit (ILC) used as security will expire before the end of the period of required security.
The Panel finds that the invoices do not specify the payment terms stipulated in the contract except to note that payment is to be effected in United States dollars through an irrevocable letter of credit .
小组认定,发票没有具体说明合同规定的付款条件,仅说明付款应通过一张 不可撤消信用证 以美元支付。The direct payments by the Employer specified in sub-paragraph (b) shall be made by an irrevocable letter of credit established by the Employer in favour of the Contractor and confirmed by a bank acceptable to the Contractor.
对于本款中所规定的雇主向承包商的直接付款方式应为,由雇主开具的以承包商为受益人并为承包商所接受的银行保兑的 不可撤销信用证 。Letter of Credit.Buyer shall cause to be issued to Seller an irrevocable letter of credit («Letter of Credit») in the amount of the Price less the amount of the First Installment.
买方将促使向卖方签发一份 不可撤销的信用证 (»信用证»),信用证的金额为合同价格减去首期付款的金额。» irrevocable letter of credit : Form of letter of credit whereby the issuing Bank gives an undertaking to the Beneficiary that payment will be made, provided that the Beneficiary complies with the terms of the credit.»
不可撤销的信用证 :一种信用证形式,表明发证银行对受益人承担的一种义务,即只要受益人遵守信用证的条款,银行就予付款。The deferred element was to be paid by means of an irrevocable letter of credit , dated 28 November 1987, in proportion to the payments made under the credit loan agreement with respect to the 85 per cent financed Pound sterling portion.
推迟部分应以1987年11月28日的 不可撤消信用证 支付,比例参照与85%英镑部分相关的贷款协议之下的付款。Pursuant to 40 U.S.C. 3132, for construction contracts greater than $30,000, but not greater than $150,000, the contracting officer shall select two or more of the following payment protections, giving particular consideration to inclusion of an irrevocable letter of credit as one of the selected alternatives:
(1)根据40 U.S.C. 3132的规定,对于价值高于3万但不高于15万的建设工程合同,合同官员须选择下列两种或多种付款担保方式,优先考虑 不可撤销信用证 :provided, however, that if Buyer, or any person on Buyer’s behalf, provides an irrevocable letter of credit issued by a financial institution reasonably acceptable to Seller or such other suitable security acceptable to Seller at its sole discretion for payment of any undelivered Product, pursuant to Buyer’s order, Seller shall be obliged to deliver such shipment.
然而,如果要是买方或代表买方的人,提出卖方合理接受的金融组织所发的 不可撤销信用证 ,或是其它卖方接受的适用证卷,以便能全权处理任何未交货的付款,在买方的要求下,卖方应该进行交货。UNFPA responded at that point, that that was subject to the Financial Regulations and Rules of UNFPA, which states that «fully funded» shall mean that funds in support of a project are available in the form of cash received, an irrevocable letter of credit or, subject to guidelines established by the Executive Director, an agreement signed by UNFPA and the donor.
人口基金就此答复说,这要遵从《人口基金财务条例和细则》,其中规定,»筹足资金»是指有用于项目的现金或 不可撤销信用证 ,或在符合执行主任制定的准则的情况下,有人口基金和捐助者签订的协议。The bonds shall be in the form of firm commitment, supported by corporate sureties whose names appear on the list contained in Treasury Department Circular 570, individual sureties, or by other acceptable security such as postal money order, certified check, cashier’s check, irrevocable letter of credit , or, in accordance with Treasury Department regulations, certain bonds or notes of the United States.
保证金应采用坚定承诺形式,由名称列于财政部的通知570所载的名单公司保证人、个人担保人或其他可接受的保证人提供支持,如邮政汇票、保付支票、银行本票、 不可撤销的信用证 ,或根据财政部的规定,由美国的某些债券或票据提供支持。28.204-3 Irrevocable letter of credit (ILC).
letter of credit — Translation into Arabic — examples English
These examples may contain rude words based on your search.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
Покупателю было предложено произвести оплату посредством аккредитива .
Контракт предусматривал оплату аккредитивом .
28000 Взнос в форме аккредитива .
Также исключаются уступки дебиторской задолженности по аккредитиву () или независимой гарантии).
53- وإحالات المستحقات الناشئة بموجب اب اعتماد و كفالة مستقلة ي مستبعدة أيضاً).Реквизиты платежа (тратта безотзывного аккредитива и др.)
تفاصيل الدفع) مشروع اب اعتماد غير ابل للغاء ، وما إلى ذلك (В контракте упоминалась оплата аккредитивом к указанной дате.
وار العقد لى دفع الثمن بموجب اب اعتماد بحلول تاريخ محدد.SRM Refineries согласилась выплатить ATEP сумму в 30 миллионов евро, подлежащую оплате по подтвержденному аккредитиву , следующим образом:
(أ) وافقت ركة «SRM Refineries» ن تسدد لشركة «ATEP» моложе 30 мес.54A1 Распространенные примеры: оформление аккредитива
SerVaas получила свой первый авансовый платеж по аккредитиву в марте 1989 года.
1218- وتلقت سيرفاس الدفعة الأولى من المبلغ بمقتضى خطاب اعتماد ادر في آذار / مارس 1989.Для этого в каждый аккредитив необходимо включить следующие положения:
ولهذا الغرض ، يتعين ن تُدرج في كل اب اعتماد احكام التالية:Банк передает контролерам аккредитив .
Следовательно, открывать аккредитив не было необходимости.
Однако Генеральный секретарь просит сохранить разрешение на открытие аккредитива , предусмотренное в резолюции 61/251.
بيد ن الأمين العام يطلب الحفاظ على الموافقة على تقديم اب اعتماد الواردة ي القرار 61/251.26 марта 1990 года банк «Рашид» открыл аккредитив в пользу «Истерн».
236-وفي 26 ار / مارس 1990 تح مصرف الرشيد اب اعتماد لصالح الشرقية.Оплата четвертого проекта должна была производиться по аккредитиву .
«Ленцинг» заявила, что 20 декабря 1989 года был открыт аккредитив по обоим контрактам.
17- وذكرت ركة لنزينغ أنه تم في 20 انون الأول / ديسمبر 1989 دار اب اعتماد لكلا العقدين.Покупатель оплатил цену через аккредитив в соответствии с требованиями контракта.
وقد دفع المشتري الثمن عن ريق اب اعتماد بحسب ما يقتضيه العقد.Стороны обменялись факсимильной и телефонной связью на условиях соглашения, в том числе о способе оплаты (аккредитив , ).
وتبادل الطرفان اتصات ، بواسطة الفاكس والتليفون بشأن أحكام اتفاق ، بما في ذلك ريقة الدفع) ادع.Если открытый аккредитив не соответствует информации, указанной в заявке, контролеры должны немедленно сообщить об этом Комитету.
وا لم يكن اب اعتماد المفتوح متفقا مع المعلومات المقدمة ي الطلب يخطر يخطر المفتشونة اللجنة اللول.К письму прилагается копия контракта, проект безотзывного аккредитива , подлежащего открытию, и все сопроводительные документы.
مرفق طيه نسخة من العقد ، ومشروع اعتماد ير القابل للغاء المقرر فتحه ، وجميع الوثائق المؤيع الوثائق المؤيع الوثائق المؤيع اللابل للغاء المقرر فتحه ، وميع الوثائق الميع الوثائق الميع اللابل. Аккредитивв аккредитиве гуджарати, что означает
6, дает 0.0006 секунд.
аккредитив в гуджарати
аккредитив | Гуджарати словарь переводит английский на гуджарати и гуджарати на английский аккредитив слов аккредитив фраз с аккредитивом синонимов аккредитива антонимов аккредитива произношения.
значений аккредитива в гуджарати
аккредитив в Гуджарати Гуджарати перевода аккредитива Гуджарати значение аккредитива что такое аккредитив в словаре гуджарати? определение, антоним и синоним аккредитива
аккредитив Антоним, Синоним Тезаурус
Официальные языки Индии. Перевод словаря значительно лучше, чем перевод Google, предлагает несколько значений, список альтернативных слов аккредитива, фразы с аналогичными значениями на гуджарати | ગુજરાતી, гуджарати | ગુજરાતી словарь гуджарати | ગુજરાતી перевод аккредитива аккредитив означает определение аккредитива антоним аккредитива синоним аккредитива Справочная работа на языке гуджарати для поиска синонимов, антонимов аккредитива.
Аккредитив в гуджаратиЭта страница представляет собой онлайн-лексический ресурс, содержащий список аккредитивов, например слов на языке гуджарати в алфавитном порядке, и который сообщает вам, что они означают, на том же или других языках, включая английский.
Введите термин «аккредитив» для перевода
Вы можете ввести слово, скопировав и опубликовав, перетащив его или введя текст в поле поиска выше, чтобы узнать значение аккредитива.
राजभाषाकोश: KHANDBAHALE.COM — это платформа цифрового словаря для 22 официальных языка Индии с обширным словарным запасом из 10+ миллионов слов, значений и определений. Предлагаемые языки: Ассамский অসমীয়া Бенгальский বাংলা Бодо बड़ो Догри डोगरी английский Гуджарати ગુજરાતી Хинди हिन्दी Каннада ಕನ್ನಡ Кашмири कॉशुर Конкани कोंकणी Майтхили মৈথিলী Малаялам മലയാളം Манипури মৈতৈলোন্ Маратхи मराठी Непальский नेपाली Ория ଓଡ଼ିଆ Панджаби ਪੰਜਾਬੀ Санскрит संस्कृतम् Сантали Синдхи سنڌي Тамильский தமிழ் Телугу తెలుగు Урду اُردُو.
KHANDBAHALE.COM — это цифровой ресурс номер один в мире, основанный на знаниях индийских языков, который предпочитают более ста миллионов изучающих языки, студентов-преподавателей, авторов, переводчиков и ученых в различных областях по всему миру.
Перевод метода ЖХ — Объем выдержки — Wiki — Расходные материалы
Объем выдержки в жидкостной хроматографии, ЖХ, — это объем от смесителя до головки колонки. В системе с двумя насосами со смешиванием под высоким давлением объем выдержки отмечен желтым прямоугольником:
В системе смешивания низкого давления с одним насосом и дозирующим клапаном он отличается и отмечен желтым прямоугольником:
В изократических прогонах объем выдержки не влияет на разделение.
В градиентных системах существует значительное влияние при переносе метода в другой столбец или систему. По крайней мере, это тот случай, когда живые объемы двух систем различаются. Имейте в виду, что объем выдержки — это дополнительный мертвый объем, который влияет на то, когда изменение градиента достигает заголовка столбца. Чем больше объем задержки, тем больше времени потребуется, чтобы добраться до заголовка столбца.
Два возможных случая:
- Объем задержки системы 1 больше, чем объем задержки системы 2:
В этом случае изменение градиента достигает заголовка столбца системы 2 раньше, чем ожидалось.Чтобы получить хроматограмму, аналогичную системе 1, вы должны добавить дополнительное время изократической выдержки в начале аналитического цикла, чтобы компенсировать этот эффект. - Объем задержки системы 1 меньше, чем объем задержки системы 2:
В этом случае градиентное изменение достигает заголовка столбца системы 2 позже, чем ожидалось. Чтобы получить хроматограмму, аналогичную системе 1, вы должны сначала запустить цикл без впрыска, после необходимого времени компенсации (времени до впрыска), которое вы вводите.
Вот графический пример того, как нужно отрегулировать исходный градиент при изменении объемов задержки. Поток = 1 мл / мин, а объемы выдержки 1 или 2 мл, чтобы не усложнять:
Синий — исходный градиент, оранжевый — с изократическим временем выдержки (объем выдержки 1> объем выдержки 2), а зеленый — это один с временем предварительного впрыска (объем выдержки 1 <объем выдержки 2). Все три градиента в трех системах покажут одну и ту же хроматограмму.
Определение объема задержки
Для этого расчета колонку в системе необходимо заменить трубкой очень малого объема, предпочтительно с внутренним объемом 15 мкл или меньше.Растворителем A является вода, а растворителем B — вода с 0,1% ацетоном или любым другим УФ-поглощающим растворителем. Ацетон имеет УФ-поглощение при 265 нм, и детектор легко обнаружит увеличивающееся количество ацетона.
Запустите градиент от 100% A до 100% B в любое время (время градиента, t Градиент ) и запишите хроматограмму.
- Метод 1:
Проведите касательную линию через точку перегиба хроматограммы. Время пересечения этой линии с базовой сигнальной линией и есть время выдержки.
- Метод 2:
Время градиента известно для прогона. Половина расстояния между верхней и нижней базовой линией. От точки высоты 50% пусть линия, параллельная базовой линии, пересекает хроматограмму. Время этой точки пересечения t 50% . Время выдержки t 50% — 0,5 · t Градиент .
Для обоих методов время задержки умножается на поток, чтобы получить объем задержки.
Объем задержки vs.мертвый объем
Не путайте мертвый объем с объемом задержки. Мертвый объем — это только его часть — объем от инжектора до головки колонки.
Ссылки
- «Измерьте объем пребывания», Европейская Фармакопея 7.0, 2.2.46.
Секвестрация IFIT1 ухудшает трансляцию 2’O-неметилированной кэпированной РНК
Abstract
Вирусы, которые генерируют кэпированную РНК, лишенную 2’O-метилирования на первой рибозе, серьезно страдают от противовирусной активности интерферонов типа I.Мы использовали протеомную аффинную очистку в сочетании с масс-спектрометрией, чтобы идентифицировать белки человека и мыши, специфически связывающиеся с кэпированной РНК с различными состояниями метилирования. Этот анализ, дополненный экспериментами по функциональной проверке, показал, что IFIT1 является единственным индуцированным интерфероном белком, проявляющим более высокое сродство к неметилированной, чем к метилированной кэпированной РНК. IFIT1 связывает видоспецифичный белковый комплекс, состоящий из других IFIT, с РНК. Импульсное мечение стабильных изотопов с аминокислотами в культуре клеток в сочетании с масс-спектрометрией, а также анализом конкуренции in vitro и показывают, что IFIT1 секвестрирует 2’O-неметилированную кэпированную РНК и тем самым ухудшает связывание факторов инициации трансляции эукариот с 2’O-неметилированной РНК. шаблон, что приводит к запрету перевода.Специфичность IFIT1 в отношении 2’O-неметилированной РНК служит мощным противовирусным механизмом против вирусов, лишенных 2’O-метилтрансферазной активности, и в то же время позволяет беспрепятственно продвигать противовирусную программу в инфицированных клетках.
Сведения об авторе
Клеточные информационные РНК высших эукариот кэпированы метилированным гуанином и, кроме того, метилированы в положении 2’O первой рибозы. Вирусы, неспособные метилировать свою РНК в положении 2’O кэпа, и вирусы, генерирующие незаполненную РНК с 5′-трифосфатными группами, ингибируются противовирусным комплексом различных белков IFIT.Как белки IFIT ограничивают вирусы, лишенные 2’O-метилирования в кэпе РНК, остается неясным. Мы использовали подход, основанный на масс-спектрометрии, для идентификации связывания белков с кэпированной РНК с различными состояниями метилирования. Мы обнаружили, что IFIT1 напрямую связывается с кэпированной РНК и что это связывание зависит от состояния метилирования кэпа. Установив, что IFIT1 является центральным для распознавания 2’O-неметилированной вирусной РНК, мы дополнительно исследовали механизм действия IFITs in vitro и in vivo .Наши эксперименты ясно показывают, что противовирусный механизм IFIT1 основан на секвестрации вирусной РНК, лишенной метилирования cap 2’O, тем самым избирательно предотвращая трансляцию вирусной РНК. Наши данные устанавливают IFIT1 в качестве общего сенсора для 5′-концевых структур РНК и представляют собой важное недостающее звено в нашем понимании противовирусной активности белков IFIT.
Образец цитирования: Habjan M, Hubel P, Lacerda L, Benda C, Holze C, Eberl CH, et al. (2013) Секвестрация IFIT1 нарушает трансляцию 2’O-неметилированной кэпированной РНК.PLoS Pathog 9 (10): e1003663. https://doi.org/10.1371/journal.ppat.1003663
Редактор: Майкл С. Даймонд, Школа медицины Вашингтонского университета, Соединенные Штаты Америки
Поступила: 4 апреля 2013 г .; Принята к печати: 12 августа 2013 г .; Опубликовано: 3 октября 2013 г.
Авторские права: © 2013 Habjan et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана программой Free-Floater Общества Макса Планка для AP, Европейским исследовательским советом (iViP) для AP, Исследовательским сообществом Гумбольдта для MH и Немецким исследовательским обществом (DFG; SFB1022) для JZ. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Эффективный контроль вирусной инфекции со стороны организмов-хозяев требует обнаружения патогенов и активации соответствующих защитных механизмов [1] — [3].Одним из компонентов, обычно воспринимаемых хозяином, является вирусный генетический материал, будь то ДНК, доставленная в цитоплазму через вирусную инфекцию, или мотивы, несущие вирусную РНК, которые обычно не встречаются на эукариотических РНК [4], [5]. Большинство клеточных цитоплазматических РНК являются одноцепочечными и несут 5’монофосфат (рРНК и тРНК) или метилированный гуанозиновый кэп N7 (мРНК), связанный через 5′-5′-трифосфатный мостик с первым основанием. У высших эукариот мРНК дополнительно метилируется в положении 2’O первой рибозы [6], [7].Вирусы, напротив, могут образовывать длинную двухцепочечную РНК (дцРНК) и генерировать РНК, несущие 5′-трифосфаты (PPP-РНК) или РНК, лишенные метилирования [8] — [10]. Было показано, что все эти отличительные особенности вирусных, а не клеточных РНК активируют врожденную иммунную систему и вызывают синтез противовирусных цитокинов, включая интерфероны типа I (IFN-α / β), которые в конечном итоге ограничивают рост вируса [11] — [14] . Среди белков, которые воспринимают вирусную РНК и связаны с синтезом IFN-α / β, есть ген I, индуцируемый ретиноевой кислотой (RIG-I) и ген 5, связанный с дифференцировкой меланомы (Mda-5), которые образуют семейство RIG-подобных рецепторы (RLR) [5].Дальнейший набор белков-хозяев, по-видимому, связывает вирусные РНК, чтобы напрямую ингибировать продукцию вируса [8]. Некоторые из этих белков сильно экспрессируются при стимуляции клеток цитокинами, такими как IFN-α / β, и их противовирусные эффекты проявляются только после связывания с вирусной нуклеиновой кислотой. Яркими примерами таких белков являются связывающие дцРНК белки, такие как активированная дцРНК протеинкиназа R и 2′-5′-олигоаденилатсинтетаза, и белки, которые связывают РРР-РНК, такие как индуцированные интерфероном белки с тетратрикопептидными повторами (IFIT) 1 и -5 [ 3], [15], [16].Мало что известно о репертуаре клеточных белков, распознающих неметилированные кэп-структуры, хотя репликация вирусов с неактивной РНК 2’O-метилтрансферазой сильно ингибируется IFN-α / β in vitro и in vivo [11], [15] ]. Часть этой противовирусной активности была генетически связана с Ifit1 и -2 у мышей [17] — [19]. Здесь мы использовали беспристрастный подход на основе масс-спектрометрии для идентификации клеточных белков, которые связываются с 5′-неметилированной и метилированной кэпированной РНК, и исследовали их вклад в противовирусные ответы хозяина.
Результаты
Идентификация белков человека и мыши, связывающих кэпированную РНК
Для идентификации белков, которые взаимодействуют с 5′-кэпированной РНК, мы использовали протеомный подход, основанный на аффинной очистке и масс-спектрометрии (AP-MS) [16]. РНК, несущая концевой 5′-гидроксил (ОН-РНК), 5′-трифосфат (PPP-РНК), неметилированный кэп (CAP-РНК), метилированный кэп гуанозин-N7 (CAP0-РНК) или метилированный кэп гуанозин-N7 и первый нуклеотид, метилированный рибозой-2’O (CAP1-РНК), был присоединен к агарозным шарикам.Затем шарики инкубировали с лизатами наивных клеток HeLa или клеток HeLa, обработанных IFN-α, для увеличения количества противовирусных белков (рис. 1а, рис. S1). Используя жидкостную хроматографию в сочетании с тандемной масс-спектрометрией (LC-MS / MS) с последующим количественным протеомным анализом взаимодействия, мы идентифицировали 528 белков, которые взаимодействовали с немодифицированными или покрытыми РНК гранулами (рис. S2a, таблица S1). Хотя большое количество белков было одинаково хорошо представлено во связанных фракциях, полученных со всеми РНК (рис.S2a), 68 белков оказались значительно обогащенными в образцах, извлеченных с помощью 5′-модифицированной РНК, по сравнению с ОН-РНК (рис. S2b). Как и ожидалось, PPP-РНК-связывающие белки RIG-I (DDX-58), комплекс IFIT1, -2, -3 и IFIT5 были обогащены аффинной очисткой PPP-РНК лизата клеток HeLa, обработанного IFN-α (рис. 1b). ), обосновав подход и подтвердив предыдущие данные [16]. Используя неметилированную CAP-РНК в качестве приманки, мы значительно обогатили белками, которые, как известно, связываются с клеточно-кэпированной РНК (12 из 16 белков) (рис.1c, Рис. S2b, Таблица S1). Однако важной особенностью клеточных мРНК является метилирование в положении N7 гуанозинового кэпа и положении рибозы-2’O первого нуклеотида (CAP1). Известно, что метилирование N7 увеличивает сродство кэп-структуры к таким белкам, как EIF4E и другим кэп-связывающим белкам [6], [7]. Зависимое от метилирования увеличение связывания белков было также очевидно в нашем анализе AP-MS, когда в качестве приманок использовали неметилированную CAP-РНК и метилированную CAP1-РНК (16 против 27 идентифицированных белков), поскольку последний захватил большее количество значительно обогащенных белков. белки и, в целом, они были обогащены в большей степени, как было измерено количественным определением без метки (рис.1c – d, таблица S1). Примечательно, что мы идентифицировали IFIT1, -2 и -3 среди не охарактеризованных белков связывания CAP-РНК, предполагая, что комплекс IFIT связывается с РНК кэп-зависимым образом (рис. 1c). IFIT5, который показывает 57,2% идентичности аминокислотной последовательности и 75,6% сходства с IFIT1 и недавно было показано, что он формирует плотно связывающийся карман, который специфически вмещает PPP-РНК [20], не был обнаружен во фракциях, которые связывали кэпированную РНК. Когда мы сравнили наш набор данных AP-MS с данными транскриптомов интерферон-стимулированных клеток [21], IFIT были единственными интерферон-индуцированными белками, которые, как было обнаружено, специфически обогащены при очистке CAP-РНК, что свидетельствует о преобладающей роли IFIT в ответах на врожденный иммунитет, направленных на против CAP-РНК (рис.1c, рис. S2b). Чтобы проанализировать, консервативен ли набор белков, которые связываются с 5′-модифицированной РНК, у других видов, мы выполнили тот же анализ AP-MS на лизатах наивных и обработанных IFN-α эмбриональных фибробластов мыши (MEF) (рис. S3a, b). , Таблица S2). Удивительно, хотя PPP-РНК специфически обогащена Ifit1, количество Ifit2 и Ifit3 не увеличилось (рис. 1e). Вместо этого мы обнаружили обогащение Ifit1c (также известного как Gm14446), не охарактеризованного белка IFIT, который сильно индуцируется IFN-α / β или вирусной инфекцией (рис.S4), предполагая, что архитектура мышиного комплекса IFIT отличается от его человеческого аналога. Значительное обогащение Ifit1 и Ifit1c также может быть достигнуто с помощью неметилированной CAP-RNA, но не с помощью метилированной CAP1-RNA, несмотря на то, что последняя приманка захватила больше белков с более высокими показателями обогащения (Fig. 1f, g). На основании этих анализов мы пришли к выводу, что как у человека, так и у мыши комплекс IFIT является единственным IFN-индуцированным компонентом, который показывает значительное сродство к кэпированной РНК.
Рис. 1. Идентификация на основе масс-спектрометрии человеческих и мышиных интеракторов кэпированной РНК.
( a ) Схематическое изображение экспериментального подхода, используемого для идентификации белков, связывающих клеточную РНК, на основе масс-спектрометрии (МС). Биотинилированную РНК с различными 5′-концевыми структурами (OH, PPP, CAP, CAP0, CAP1) связывали с гранулами стрептавидина и инкубировали с лизатами, полученными из клеток, которые не обрабатывали или обрабатывали 1000 ед. / Мл IFN-α в течение 16 часов. .Связанные белки денатурировали, алкилировали и непосредственно расщепляли трипсином. Полученные пептиды подвергали тандемной жидкостной хроматографии с дробовиком (LC-MS / MS). Для каждой РНК-приманки было проведено три независимых эксперимента, и данные были проанализированы с помощью программного обеспечения MaxQuant [37] с использованием алгоритма количественного определения без метки [38]. ( b – d ) Белки, полученные из лизатов IFN-α-обработанных клеток HeLa с использованием указанных биотинилированных РНК-приманок, анализировали с помощью LC-MS / MS. Графики вулканов показывают степени обогащения (соотношение интенсивностей белков без метки количественного определения (LFQ); ось абсцисс) и p-значений (t-критерий; ось y) PPP-РНК ( b ), CAP-RNA. ( c ) и CAP1-РНК ( d ) приманки по сравнению с ОН-РНК.Существенно обогащенные интеракторы (см. Материалы и методы) отделены гиперболической кривой (пунктирная линия) от фоновых белков (синие точки), известных белков, связывающих кэп (темно-зеленый), и белков, которые, как известно, связаны с кэпированной РНК (светло-зеленый) . Белки, индуцированные интерфероном [21], обнаруженные в значительно обогащенных фракциях (IFIT1-3 и 5, DDX58), выделены (красные треугольники). ( e – g ) Как в ( b – d ), но для лизатов обработанных IFN-α фибробластов эмбрионов мыши (MEF).Выделены интерферон-индуцированные белки Ifit1 и Ifit1c [42] в значительно обогащенных и необогащенных фракциях.
https://doi.org/10.1371/journal.ppat.1003663.g001
IFIT1 — единственный IFIT, который связывает кэпированную РНК
Поскольку человеческие IFIT1, -2 и -3 связываются друг с другом, образуя мультибелковый комплекс, мы хотели определить, какой из них отвечает за связывание комплекса IFIT с неметилированной CAP-РНК. Мы сверхэкспрессировали каждый из белков IFIT, помеченных люциферазой Renilla , в клетках 293T и выполнили аффинную очистку с использованием ОН-РНК, PPP-РНК и CAP-РНК.Примечательно, что при использовании CAP-РНК в качестве приманки были обнаружены только IFIT1 человека и мыши (рис. 2a, b), что позволяет предположить, что IFIT1 опосредует связывание комплекса IFIT с CAP-РНК. В соответствии с анализом MS, IFIT5 связывается исключительно с PPP-RNA, но не с CAP-RNA. Чтобы исключить вклад клеточных факторов во взаимодействие между IFIT1 и CAP-РНК, мы использовали рекомбинантные человеческие белки IFIT для осаждения РНК, что подтвердило прямое взаимодействие IFIT1 с кэпированной РНК (рис. 2c). Подход к моделированию на основе структуры с использованием IFIT5 [20] в качестве матрицы предполагает, что полость связывания РНК IFIT1 на ∼700 Å 3 больше, чем у IFIT5 (рис.S5) — подразумевая, что IFIT1 имеет несколько другие свойства связывания РНК. Однако лизин в положении 151 и аргинин в положении 255 IFIT1, два остатка, участвующих в связывании концевой 5′-трифосфатной группы на PPP-РНК посредством IFIT5 и IFIT1 [20], также были необходимы для связывания IFIT1 с кэпированной РНК ( Рис. 2d), что указывает на общий аналогичный режим привязки.
Рисунок 2. IFIT1 человека и мыши связывается непосредственно с неметилированной кэпированной РНК.
( a ) Выделение белков IFIT человека, меченных люциферазой (hIFIT), из трансфицированных клеток 293T с помощью гранул, покрытых 250 нг РНК, несущей 5 ‘OH, PPP или CAP.На графиках показана активность люциферазы после аффинной очистки (AP) с помощью PPP-РНК и CAP-РНК (нормализованная по ОН-РНК) и активность 10% введенных лизатов. (b ) Получены данные (как в a ) для меченных люциферазой мышиных белков Ifit (mIfit), аффинно очищенных с помощью PPP-РНК и CAP-РНК. ( c ) Рекомбинантные меченные His hIFIT1, -2, -3 и -5 инкубировали только с шариками или шариками, покрытыми ОН-РНК или САР-РНК. Связанные белки выявляли вестерн-блоттингом. Входные данные показывают 1/10 и от количества, инкубированного с шариками.( d ) Очистка меченных люциферазой мутантов дикого типа (WT) и hIFIT1 с помощью бусинок, покрытых CAP-РНК. Графики показывают активность люциферазы после аффинной очистки и активность 10% введенных лизатов. ( e ) Отношения интенсивностей LFQ белков, идентифицированных с помощью масс-спектрометрии в преципитатах CAP-РНК, по сравнению с OH-РНК в обработанных IFN-α MEF дикого типа (Ifit1 + / + , серые столбцы) и Ifit1 -дефицитные (Ifit1 — / — , черные полосы) C57BL / 6 мышей. Столбики ошибок показывают средние значения (± стандартное отклонение) трех независимых аффинных очисток.Звездочки указывают отношения с отрицательными значениями.
https://doi.org/10.1371/journal.ppat.1003663.g002
Чтобы предоставить дополнительные доказательства того, что связывание IFIT1 действительно отвечает за связывание комплекса IFIT с CAP-РНК, мы провели эксперименты AP-MS с диким типом (Ifit1 + / + ) и мутантные, Ifit1-дефицитные (Ifit1 — / — ) MEF. Общая эффективность преципитации была сопоставимой для обоих типов клеток, о чем свидетельствует одинаковое обогащение РНК-связывающего белка Syncrip и связывающего кэп белка Ncbp1 (рис.2e и рис. S4b). Ifit1c не был обогащен преципитатами из Ifit1 — / — MEFs, что согласуется с представлением о том, что мышиный комплекс Ifit связывается с CAP-РНК через Ifit1. Эти результаты показывают, что специфические связывающие свойства IFIT1 важны для рекрутирования комплексов IFIT человека и мыши на их РНК-мишени.
Связывание IFIT1 зависит от статуса метилирования кэпа РНК
Чтобы идентифицировать белки, которые связывают кэпированную РНК зависимым от метилирования образом, мы использовали неметилированную CAP-РНК и полностью метилированную CAP1-РНК в качестве приманки с обработанными IFN лизатами клеток HeLa и количественно оценили захваченные белки с помощью LC-MS / MS.Как и ожидалось [6], [7], большинство клеточных белков были значительно обогащены фракцией, связанной с CAP1-РНК (рис. 3a, рис. S2c). Наиболее заметными исключениями были IFIT и клеточная 2’O-метилтрансфераза FTSJD2, обе из которых явно благоприятствовали CAP-РНК (рис. 3a, рис. S2c и рис. 1 c, d и f, g). Мы подтвердили данные МС серией преципитации РНК с последующим вестерн-блоттингом на эндогенные белки. Белки, связывающиеся с РНК 5′-независимым образом, такие как ILF3, осаждаются одинаково хорошо независимо от используемой РНК (рис.3б). Метилирование Cap N7 увеличивало ассоциацию EIF4E с РНК, а метилирование положения 2’O не влияло на эффективность преципитации. В соответствии с результатами МС, IFIT1 хорошо связывался с неметилированной CAP-РНК и CAP0-РНК (метилированный кэп N7), но обнаруживал пониженное связывание с CAP1-РНК (метилированный кэп N7 и 2’O-метилированный первый рибо).
Рисунок 3. IFIT1 связывает кэпированную РНК в зависимости от состояния метилирования.
( a ) Отношение интенсивностей LFQ белков, идентифицированных с помощью ЖХ-МС / МС как значительно обогащенных CAP1-РНК, по сравнению с аффинными очистками CAP-РНК от IFN-обработанных клеток HeLa после фильтрации против набора белков, которые показали обогащение по отношению к 5′-ОН-РНК (см. рис.S2b). Столбики ошибок показывают средние значения (± стандартное отклонение) трех независимых аффинных очисток. (b ) Осаждение эндогенных белков из лизатов обработанных IFN-α клеток HeLa с биотинилированной РНК, несущей структуры 5 ‘OH, PPP, CAP, CAP0 или CAP1. Человеческий IFIT1 (hIFIT1), EIF4E и ILF3 в преципитатах определяли вестерн-блоттингом. Входные данные показывают 1/10 th (mIFIT1, EIF4E) и 1/30 th (hIFIT1) от количества, инкубированного с шариками. ( c ) Аффинная очистка меченного люциферазой человеческого (hIFIT1) и мышиного (mIfit1) IFIT1, экспрессированного в клетках 293T на шариках, несущих 5′-ОН, CAP, CAP0 или CAP1 РНК.( d ) Связывание рекомбинантного IFIT1 с кэпированными РНК. Как в ( c ), но покрытые РНК шарики инкубировали с рекомбинантным His-меченным мышью Ifit1 (His-mIfit1), His-hIFIT1 человека или His-EIF4E человека и количественно связанный белок определяли вестерн-блоттингом. ( e ) Связывание рекомбинантных His-меченых hIFIT1 и EIF4E с химически синтезированными олигомерами биотинилированной РНК. Синтетические трифосфорилированные РНК с (CAP1) или без (CAP0) 2’O-метильной группы на первой рибозе были кэпированы in vitro с использованием рекомбинантного кэпирующего фермента вируса осповакцины (см. «Материалы и методы»).В качестве контроля использовали синтетическую РНК, несущую 5′-гидроксильную группу (ОН). Синтетические РНК связывали с шариками, инкубировали с рекомбинантными белками, а связанные белки определяли вестерн-блоттингом. Входные данные показывают 1/10 и от количества, инкубированного с шариками.
https://doi.org/10.1371/journal.ppat.1003663.g003
Затем мы проверили вклад отдельных сайтов метилирования кэпа в связывание IFIT1. С этой целью мы измерили связывание меченого люциферазой человеческого и мышиного IFIT1 с CAP-, CAP0- или CAP1-РНК.Приманка неметилированной САР-РНК захватывала больше IFIT1 человека или мыши, чем любая из метилированных РНК (фиг. 3c). Кроме того, анализ показал, что метилирование N7 кэпа и метилирование 2’O первой рибозы способствовали снижению связывания IFIT1 с РНК. Точно так же эффективность преципитации рекомбинантного IFIT1 человека и мыши снижалась, когда кэпированные транскрибируемые in vitro РНК были ферментативно метилированы в положениях N7 и 2’O (рис. 3d) или когда использовались химически синтезированные РНК с такими же модификациями (рис. .3д). Это отличалось от EIF4E, который демонстрировал заметное связывание при использовании CAP0- или CAP1-РНК (рис. 3d, e). В совокупности эти данные предполагают, что человеческий и мышиный IFIT1 обладают способностью непосредственно определять состояние метилирования кэпированной РНК.
Противовирусная активность IFIT1 против вирусов, дефицитных по 2’O-метилтрансферазе
Установив, что IFIT1 непосредственно связывается с кэпированной РНК и что метилирование в положении 2’O первой рибозы заметно снижает связывание, мы проверили влияние IFIT1 на репликацию вируса.Вероятно, в результате эволюционного давления большинство вирусов, инфицирующих высшие эукариоты, развили механизмы для генерации РНК, которая метилирована как в позиции N7 гуанозиновой шапки, так и в позиции 2’O первой рибозы [9]. Поэтому мы использовали коронавирус человека дикого типа (HCoV) 229E (229E-WT), который генерирует CAP1-РНК, и мутантный вариант, который имеет единственную аминокислотную замену (D129A) в вирусной 2’O-метилтрансферазе, которая является частью -структурный белок 16 (229E-DA) и, следовательно, продуцирует только CAP0-РНК [11].Обработанные IFN-α клетки HeLa, инфицированные мутантом 229E-DA, экспрессировали значительно более низкие уровни вирусной РНК и белка по сравнению с клетками, подвергнутыми воздействию 229E-WT (фиг. 4a, b). Более того, этот эффект строго зависел от IFIT1, поскольку два вируса одинаково хорошо реплицировались в клетках HeLa, обработанных siRNA против IFIT1 (рис. 4a, b). Подобные эффекты наблюдались на аналогичной модели мышей. Таким образом, когда обработанные IFN-α макрофаги (MΦs) от мышей C57BL / 6 (Ifit + / + ) были инфицированы мышиным коронавирусом дикого типа (штамм вируса гепатита мыши A59; MHV-WT) и мутантным штаммом, несущим эквивалентная аминокислотная замена (D130A) в его 2’O-метилтрансферазе [11], [17] (MHV-DA), последняя продуцировала в 100 раз меньше вирусной РНК и сравнительно снизила уровни вирусного белка (рис.4в, г). Напротив, когда Ifit1-дефицитные MΦs были инфицированы, не наблюдалось значительных зависимых от вирусов различий, что снова указывает на критическую роль Ifit1 в ограничении репликации MHV-DA. Обратите внимание, что присутствие самого Ifit1 не увеличивало продукцию IFN-α / β (рис. S6), что свидетельствует о прямом противовирусном эффекте Ifit1. Затем мы оценили влияние Ifit1 на рост вируса in vivo . MHV-WT рос до высоких титров в селезенке инфицированных мышей Ifit1 + / + , тогда как при инфицировании MHV-DA репликация вируса не определялась (рис.4д). В соответствии с данными in vitro , рост MHV-DA был частично восстановлен у животных с дефицитом Ifit1. Эти данные предполагают, что IFIT1 играет центральную роль в сдерживании роста 2’O-метилтрансферазодефицитных коронавирусов in vitro и in vivo , что совместимо с большей аффинностью IFIT1 к не-2’O-метилированным кэпам РНК. конструкции. Данные также предполагают, что эта роль сохраняется у мышей и людей.
Рис. 4. IFIT1 ингибирует вирусную РНК и синтез белка в клетках, инфицированных коронавирусом с дефицитом 2’O-метилтрансферазы.
( a – b ) клеток HeLa котрансфицировали в течение 48 часов конструкцией для экспрессии рецептора HCoV-229E, аминопептидазы N человека и миРНК, нацеленных на IFIT1 или зеленый флуоресцентный белок (GFP). Затем клетки обрабатывали 20 ед. IFN-α и инфицировали HCoV-229E дикого типа (229E-WT; серые столбцы) или мутантом HCoV-229E (D129A) с дефицитом 2’O-метилтрансферазы (229E-DA; красные столбцы) . Суммарную РНК и белок собирали через 24 часа после инфицирования и анализировали с помощью количественной ОТ-ПЦР ( a ) и вестерн-блоттинга ( b ) соответственно.Количественные данные ОТ-ПЦР взяты из одного из трех репрезентативных экспериментов, показывающих средние значения ± стандартное отклонение для РНК нуклеопротеина HCoV-229E (229E-N) после нормализации до мРНК циклина B (CycB). ( c – d ) Макрофаги костного мозга (Mφ), полученные из C57BL / 6 (Ifit1 + / + ) и Ifit1-дефицитных (Ifit1 — / — ) мышей лечили или не лечили 50 ед. IFN. -α в течение 2 часов и инфицированы MHV дикого типа (WT; серые столбцы) или MHV с дефицитом 2’O-метилтрансферазы (DA; красные столбцы). РНК и белок собирали через 8 часов после заражения и анализировали с помощью количественной ОТ-ПЦР ( c ) и вестерн-блоттинга ( d ).Количественные результаты ОТ-ПЦР получены в одном из трех репрезентативных экспериментов, показывающие средние значения ± стандартное отклонение для РНК нуклеопротеина MHV (MHV-N) после нормализации к мРНК TATA-связывающего белка (TBP). ( e ) Мышей Ifit1 + / + и Ifit1 — / — внутрибрюшинно инфицировали 5000 бляшкообразующих единиц MHV WT (серые столбцы) или DA (красные столбцы). Титры вирусов в селезенках у 12 мышей в каждом состоянии измеряли через 48 часов после заражения. Данные представлены в виде диаграмм Тьюки с коробками-усами (ND, не обнаруживается; выбросы обозначены черной точкой).
https://doi.org/10.1371/journal.ppat.1003663.g004
IFIT1 специфически регулирует трансляцию 2’O неметилированной кэпированной вирусной РНК
Кеппинг РНКнеобходим для множества клеточных функций. Наличие 5′-кэпа регулирует экспорт мРНК из ядра, защищает РНК от деградации и необходимо для эффективной трансляции [7], [22]. Участие IFIT1 в ядерно-цитоплазматическом транспорте маловероятно, учитывая исключительно цитоплазматическую локализацию белков IFIT и их отрицательное влияние на коронавирусы, которые реплицируются в цитоплазме.Поэтому мы измерили стабильность РНК, генерируемых MHV-WT или MHV-DA в MΦ, которые стимулировались IFN-α. Поскольку MHV-WT реплицируется значительно лучше, чем мутантный вирус, мы заблокировали репликацию вируса, добавив циклогексимид (CHX) вскоре после заражения MΦ двумя вирусами (рис. 5a). CHX ингибирует de novo синтез вирусной полимеразы, что является предпосылкой для транскрипции вирусной РНК, и тем самым позволяет нормализовать вирусные транскрипты в клетках, инфицированных коронавирусом. Обилие вирусных транскриптов через 4 и 8 часов после инфицирования было неотличимо в обработанных CHX клетках, инфицированных MHV-WT и MHV-DA (рис.5b), предполагая, что 2’O-метилирование первой рибозы не влияет на стабильность вирусной РНК в пределах временных рамок этого эксперимента.
Рис. 5. IFIT1 специфически блокирует трансляцию 2′-O-неметилированной кэпированной вирусной РНК.
( a ) План эксперимента, используемый для оценки стабильности РНК MHV в инфицированных клетках. Макрофаги, происходящие из костного мозга (Mφ) мышей C57 / BL6, обрабатывали 50 ед. IFN-α в течение 2 ч до инфицирования MHV дикого типа (WT) или MHV с дефицитом 2’O-метилтрансферазы (DA) при 4 °. C в течение 1 ч.Непосредственно после заражения клетки обрабатывали 100 мкг / мл циклогексимида (CHX) или ДМСО. Тотальную РНК собирали через 0, 4 и 8 ч после заражения и анализировали с помощью количественной ОТ-ПЦР. (b ) РНК нуклеопротеина MHV (MHV-N) в клетках, инфицированных MHV WT (серый) или мутантом DA (красный), обработанных DMSO (сплошные линии) или CHX (пунктирные линии). Приведены данные одного репрезентативного эксперимента из трех, показывающие средние значения ± стандартное отклонение после нормализации до известного количества транскрибированной in vitro РНК люциферазы Renilla (Ren), добавленной к клеточным лизатам.( c ) Схема эксперимента для импульсного SILAC, связанного с масс-спектрометрией, для определения относительных изменений трансляции белка во время инфекции. Макрофаги от мышей C75 / BL6 (Ifit1 + / + ) и мышей с дефицитом Ifit1 (Ifit1 — / — ), выращенных в нормальной питательной среде, содержащей легкие (L) аминокислоты, инфицировали при 4 ° C в течение 1 ч диким типа MHV (WT) или MHV с дефицитом 2’O-метилтрансферазы (DA). Через пять часов после инфицирования клетки инкубировали с голодной средой (без Lys и Arg) в течение 30 минут, затем добавляли среду SILAC, содержащую тяжелые (H) меченые аминокислоты (Lys8, Arg10), и через 2 часа получали общий лизат белка и подвергали анализу. к анализу LC-MS / MS.( d ) Скорости трансляции для 721 клеточного белка, определенные по отношениям тяжелого (H) к легкому (L) из ЖХ-МС / МС, наносили на график в виде прямоугольных усов (усы от 10-го до 90-го перцентиля). Индивидуальные соотношения нуклеопротеина MHV (MHV-N) и мембранного белка (MHV-M) у WT- (серый) и DA-инфицированных (красный) Ifit1 + / + (кружки) и Ifit1 — / — (треугольники) ) макрофаги нанесены отдельно. Данные взяты из трех независимых экспериментов. ( e, f ) Анализ главных компонентов, основанный на действительных соотношениях H / L всех измерений из ( d ), показывающий кластеризацию отдельных выборок всего набора данных ( e ).На панели ( f ) показаны графики всех белков с учетом их вклада в вариации компонентов 1 и 2. Белки MHV обозначены синим цветом.
https://doi.org/10.1371/journal.ppat.1003663.g005
Многие клеточные противовирусные защитные механизмы обычно блокируют трансляцию мРНК, тем самым также серьезно подавляя рост вируса. Чтобы оценить глобальное влияние Ifit1 на аппарат трансляции, мы использовали импульсное мечение стабильных изотопов в культуре клеток (SILAC) [23].В импульсном SILAC немеченые клетки переносят в среду для выращивания SILAC, содержащую 13 C- и 15 N-меченый аргинин (Arg10) и лизин (Lys8). Вновь синтезированные белки включают тяжелую метку, а уже существующие белки остаются в легкой форме, что позволяет измерять относительные изменения в трансляции отдельных белков, независимо от абсолютного количества присутствующей РНК. Мы пульсировали Ifit1 + / + и Ifit1 — / — MΦs, инфицированных в течение 5½ часов либо MHV-WT, либо MHV-DA, в течение 2 часов со средой SILAC (рис.5c) и проанализировали инфицированные клетки методом LC-MS / MS с дробным протеомом. Мы смогли надежно количественно определить 721 белок с точки зрения соотношения тяжелый / легкий белок во всех трех протестированных биологических повторностях. Отношения тяжелых / легких клеточных белков были сопоставимы в Ifit1 + / + и Ifit1 — / — MΦ, независимо от вируса, использованного для инфекции (рис. 5d, рамки), что позволяет предположить, что ни присутствие Ifit1, ни инфекция с MHV-DA влиял на общую скорость трансляции в клетках. Профили экспрессии отдельных белков, которые, как известно, важны для врожденных иммунных ответов против вирусов, таких как рецептор распознавания образов RIG-I (DDX58), сигнальные молекулы (STAT1, -2, -3), индуцированные интерфероном белки (Ifi205b, Ifi35 , Gvin1) и компоненты главного комплекса гистосовместимости (h3-K1, h3-D1, Cd74) были сходными в обоих типах клеток, инфицированных любым вирусом (рис.S7). Однако трансляция вирусных нуклеокапсидов и мембранных белков избирательно снижалась в Ifit1 + / + MΦs, инфицированных MHV-DA (фиг. 5d и фиг. S7). Вариации в больших наборах данных лучше всего можно оценить с помощью анализа главных компонентов, который вычисляет переменную с наибольшим эффектом в данном наборе данных. Этот анализ показал, что Ifit1 + / + MΦs, инфицированные MHV-DA, показали наибольшую вариативность (компонент 1 составляет 55,9% вариации) по сравнению со всеми другими испытанными условиями (рис.5e), и среди всех идентифицированных белков белки MHV в основном ответственны за эту вариацию (рис. 5f). Взятые вместе, эти данные показывают, что синтез белков, кодируемых вирусными РНК, лишенными 2’O метилирования на первой рибозе, специфически ингибируется IFIT1. Экспрессия белков, кодируемых полностью метилированной РНК, таких как клеточная мРНК или 2’O-метилированная вирусная РНК, не зависит от активности IFIT1.
IFIT1 и факторы трансляции конкурируют за шаблоны мРНК
Трансляция клеточной кэпированной мРНК требует связывания кэп-связывающего белка EIF4E, который имеет высокое сродство к метилированным кэп-структурам [7], [22].Поэтому мы проверили, может ли IFIT1 конкурировать с EIF4E за связывание с матрицей РНК. Мы соединили ограниченные количества неметилированной CAP-РНК, N7-метилированной CAP0-РНК и полностью метилированной CAP1-РНК с шариками и проверили, изменяется ли связывающая способность рекомбинантного EIF4E в присутствии рекомбинантного IFIT1. Когда мы использовали CAP-RNA или CAP0-RNA, связывание EIF4E с шариками было снижено добавлением IFIT1, что позволяет предположить, что два белка конкурируют за мишень РНК (рис. 6a). Напротив, когда использовали метилированную CAP1-РНК, на количество извлеченного EIF4E не влияло присутствие IFIT1.Конкуренция между Eif4e и Ifit1 за кэпированную РНК также наблюдалась, когда общие лизаты IFN-α-стимулированных MEF использовали в качестве исходных данных для экспериментов. Неметилированная CAP-РНК захватывала значительно больше Eif4e из лизатов IFN-α, обработанных Ifit1 — / — MEF, чем из лизатов Ifit1 + / + MEF (фиг. 6b). Эта разница исчезла, когда в качестве приманки использовали метилированную CAP1-РНК (рис. 6b). Таким образом, мы пришли к выводу, что IFIT1 конкурирует с клеточными факторами инициации трансляции за мРНК, тем самым избирательно регулируя трансляцию на основе статуса 5′-метилирования присутствующих матриц РНК (рис.6в).
Рисунок 6. Конкуренция между IFIT1 и фактором трансляции EIF4E за шаблоны мРНК.
( a ) Восстановление рекомбинантного человеческого EIF4E на основе аффинного связывания РНК в присутствии или в отсутствие IFIT1. Гранулы стрептавидина связывали с 250 нг указанной РНК и смешивали с 5 мкг рекомбинантного His-меченного hIFIT1 и / или His-меченного EIF4E, как указано. Связанные белки анализировали вестерн-блоттингом с антителами, направленными против His-метки. (b ) Как в (a ), за исключением того, что покрытые РНК шарики инкубировали с лизатами обработанных интерфероном фибробластов эмбрионов мыши Ifit1 + / + и Ifit1 — / — .Связанные белки анализировали вестерн-блоттингом с антителами, направленными против мышиных Eif4e и mIfit1. ( c ) Предложенная модель опосредованного IFIT1 ингибирования трансляции 2’O-неметилированной вирусной РНК. Кепированная и 2’O-метилированная клеточная и вирусная РНК связывается с EIF4E для инициации трансляции. Вирусная мРНК, лишенная метилирования 2’O у первой рибозы, распознается IFIT1, что предотвращает связывание клеточных факторов, необходимых для эффективной трансляции. Модель основана на данных, представленных здесь и в других [16], [17], [19], [20].
https://doi.org/10.1371/journal.ppat.1003663.g006
Обсуждение
Ранее мы идентифицировали IFIT1 как белок, связывающий нуклеиновую кислоту, который распознает 5′-трифосфат, присутствующий в геномах и транскриптах большинства вирусов РНК с отрицательной цепью [16]. Здесь мы показываем, что, кроме того, IFIT1 связывает мРНК, у которых отсутствует 2’O-метилирование на первой рибозе, например те, которые продуцируются РНК-вирусами, которые реплицируются в цитоплазме и лишены РНК-cap-специфической активности рибозо-2′-O-метилтрансферазы. .Это предполагает, что IFIT1 обладает уникальной способностью распознавать модификации 5′-РНК, которые присутствуют на вирусных нуклеиновых кислотах. Эксперименты по совместной очистке с белками IFIT человека ясно показывают образование мультибелкового комплекса, включающего IFIT1, -2 и -3. Сверхэкспрессия отдельных белков IFIT, включая IFIT1, лишь незначительно влияет на рост вирусов [16], [17], предполагая, что совместное действие белков IFIT необходимо для полного противовирусного действия. Это подтверждается экспериментами по потере функции в культуре клеток и in vivo , которые показывают потребность в Ifit2, который сам по себе не связывает CAP-РНК, для ограничения вирусов, лишенных активности 2’O-метилтрансферазы [17], [18] ].IFIT2, как известно, связывается с компонентами цитоскелета [24], что может способствовать внутриклеточному перемещению комплекса IFIT к участкам его действия. Хотя некоторые IFIT обладают сохраненной биологической активностью у разных видов, например IFIT1 человека и мыши, которые связываются с РРР-РНК и неметилированной САР-РНК, другие, по-видимому, эволюционировали видоспецифическим образом. Мы показали здесь, что еще не охарактеризованный мышиный интерферон индуцированный Ifit1c связывается с покрытыми РНК гранулами Ifit1-зависимым образом, и поэтому мы предполагаем, что соответствующий комплекс Ifit с другим составом белков существует у мышей.
Остатки, ранее идентифицированные как важные для связывания трифосфатного фрагмента, также необходимы для связывания неметилированной CAP-РНК с помощью IFIT1, что свидетельствует о консервативном механизме связывания РНК. В этом контексте интересно отметить, что кристаллографический анализ показывает, что связывание PPP-РНК с IFIT5, которое демонстрирует высокое сходство с IFIT1, происходит способом, напоминающим связывание CAP-РНК белками, связывающими кэп, в том смысле, что первый два нуклеотида уложены ароматическим фенилаланином [20].Однако более высокое сродство IFIT1 к неметилированной РНК по сравнению с полностью метилированной кэпированной РНК необычно среди клеточных белков, поскольку до сих пор сообщалось, что 5′-метилирование увеличивает сродство клеточных белков к РНК [7], что четко подтверждается нашим РНК AP. -MS данные. Как и его специфическая противовирусная активность, это свойство IFIT1 может проявляться только при заражении вирусами, которые продуцируют неметилированные 5′-концы РНК [25], [26]. Мы предполагаем, что IFIT1 действует как молекулярный переключатель, который делает возможной селективную трансляцию на основе состояния 5′-метилирования мРНК.Феномен контроля трансляции с помощью IFIT1, основанный на его дифференциальной аффинности к кэпированной РНК, напоминает гомологичный белок 4E (4EHP) у дрозофилы и мышей, который, как было обнаружено, контролирует трансляцию, конкурируя с EIF4E за структуру кэпа РНК, тем самым регулируя экспрессия генов, специфичных для развития [27], [28]. Сходным образом, в наших руках IFIT1 не связан напрямую с механизмом трансляции ([16] и данные не показаны), что снова указывает на то, что он нарушает трансляцию посредством секвестрации вирусной РНК.Такая модель согласуется с высокими уровнями экспрессии белков IFIT в результате заражения вирусами или лечения IFN-α / β.
Вместо того, чтобы опосредовать общее ингибирование трансляции, IFIT1 демонстрирует высокую селективность в отношении мРНК, у которых отсутствует 5′-метилирование. Это подтверждается импульсными экспериментами SILAC, показывающими специфическое, IFIT1-зависимое ингибирование трансляции кэпированных РНК, лишенных 2’O-метилирования на первой рибозе, таких как те, которые генерируются мутантами MHV и HCoV, экспрессирующими неактивную 2’O-метилтрансферазу.Низшие эукариоты и вирусы, которые их инфицируют, лишены 2’O-метилированной CAP РНК [29] — [31], и последняя должна быть чувствительна к противовирусной активности IFIT. Следовательно, система защиты IFIT, вероятно, вносит вклад в видовой барьер, который оказывает селективное давление на вирусы, чтобы генерировать 5′-метилированную РНК. Наши данные дают механистическое обоснование того, почему большинство вирусов прилагают значительные усилия и направляют часть своей кодирующей способности на производство геномных и субгеномных РНК с 5′-концевыми концами, которые идеально имитируют таковые из клеточных мРНК, включая полностью метилированные структуры с 5′-кэпом [9 ], [31] — [33].Другие вирусы развили специфические механизмы, чтобы скрыть свои не кэпированные / неметилированные 5′-концы, например, путем ковалентного связывания вирусных белков с 5′-концом вирусных РНК и использования альтернативных стратегий инициации трансляции, тем самым избегая надзора на основе IFIT1, который сосредоточен на 5′-концевых структурах РНК. Несмотря на эти вирусные стратегии генерации мРНК, подобных хозяину, IFIT1 остается активным против вирусов, которые генерируют 5′-трифосфатную РНК, скорее всего, через независимые от трансляции механизмы.Способность IFIT1 избирательно нацеливаться на вирусные РНК позволяет клетке специфически бороться с вирусными инфекциями, выполняя противовирусную программу, направленную на уничтожение вторгающегося патогена.
Материалы и методы
Заявление об этике
Все эксперименты на животных проводились в соответствии с швейцарским федеральным законодательством о защите животных и с одобрения Комитета по изучению животных при кантональном ветеринарном управлении (Санкт-Галлен, Швейцария), номер лицензии.ГГ, 11 марта 2003 г.
Реактивы, клетки и вирусы
Интерферон-α (IFN-α A / D) был любезным подарком Петера Стахели. Экспрессионные конструкции для белков IFIT человека и мыши [16], [20] и аминопептидазы человека N (APN) были описаны ранее. Продукты, меченные люциферазой Renilla , экспрессировали из конструкций, полученных путем клонирования Gateway в pCDNA-REN-NT-GW (любезный подарок от Albrecht v. Brunn). Для экспрессии в бактериях кДНК EIF4E человека клонировали в pETG10A-GW [16].Рекомбинантные белки IFIT и EIF4E человека экспрессировали в E.coli и очищали с использованием смолы HisPur Ni-NTA (Thermo Scientific). Гранулы стрептавидин-агарозы получали от Novagen. Поликлональные антитела, направленные против IFIT1 человека и мыши, были описаны ранее [16]. Антитело против нуклеопротеина MHV (MHV-N556) любезно пожертвовал Стюарт Сидделл. Первичные антитела против ILF-3 (Sigma; HPA001897), нуклеопротеина HCoV-229E (Ingenasa; mAb 1h21) и EIF4E (Cell Signaling; C46H6) были получены из коммерческих источников.Для вестерн-блоттинга мы использовали антитела, связанные с пероксидазой хрена (HRP), специфичные к актину (Santa Cruz; sc-47778), His-tag (Santa Cruz; sc-8036) или c-Myc-tag (Roche; 1667149). и вторичные антитела, связанные с HRP (Jackson ImmunoResearch). Все используемые клеточные линии (293T, HeLa, Vero-E6, Huh7, L929, 17Clone1 и Ifit1 + / + и Ifit1 — / — эмбриональных фибробластов мыши) были описаны ранее [11], [16] и были содержится в среде DMEM (PAA Laboratories), содержащей 10% фетальной телячьей сыворотки (PAA Laboratories) и антибиотики (100 Ед / мл пенициллина, 100 мкг / мл стрептомицина).Среда DMEM, содержащая антибиотики, 10 мМ L-глутамин, 10% диализованную фетальную сыворотку теленка (PAA Laboratories) и 84 мг / л 13 C 6 15 N 4 L-аргинин и 146 мг / л 13 C 6 15 N 2 лизин (Cambridge Isotope Laboratories) использовали для экспериментов SILAC. Макрофаги, полученные из костного мозга мыши, были получены in vitro путем культивирования костного мозга из бедренной и большеберцовой кости мыши в среде DMEM с добавлением 10% (об. / Об.) Фетальной телячьей сыворотки, 5% (об. / Об.) Лошадиной сыворотки, 10 мМ HEPES pH. 7.4, 1 мМ пируват натрия, 10 мМ L-глутамин и 20% (об. / Об.) Среда, кондиционированная клетками L929 (содержащая макрофагальный колониестимулирующий фактор) в течение 6 дней. Реагенты для трансфекции плазмидной ДНК (нанофектин) или дуплексами миРНК (миРНК Prime) были получены от PAA Laboratories. Рекомбинантные коронавирусы дикого типа и 2′-O-метилтрансферазы [штамм вируса гепатита мыши A59 (MHV) и коронавирус человека 229E (HCoV-229E) [11]], вирус Сендай, RVFV Clone13 [34] и VSV-M2 ( мутантный VSV с заменой M51R в матриксном белке) [35] были описаны ранее.Дуплексные миРНК, нацеленные на человеческий IFIT1 [смысл №1: r (CAUGGGAGUUAUCCAUUGA) dTdT; антисмысловой №1: r (UCAAUGGAUAACUCCCAUG) dTdA; смысл № 2: r (CCUUGGGUUCGUCUACAAA) dTdT, антисмысловой № 2: r (UUUGUAGACGAACCCAAGG) dAdG] и зеленый флуоресцентный белок [смысл: 5 ′ r (AAGCAGCACGACUUCUUCAAGU) dT 3 ′; антисмысловой 5 ‘r (CUUGAAGAAGUCGUGCUGCUUU) dT 3’] были синтезированы Core Facility в MPI биохимии.
Кэппирование и метилирование РНК, транскрибированной in vitro
Трифосфорилированная PPP-РНК была синтезирована путем транскрипции in vitro с помощью полимеразы SP6 или T7 (RiboMAX Large Scale RNA Production Systems; Promega) в присутствии или в отсутствие биотин-16-UTP (Enzo) из плазмид, кодирующих антисмысловую 7SK РНК (7SK -as) [13] или люциферазы Renilla (pRL-SV40; Promega) и очищают осаждением изопропанолом ацетатом аммония.Затем аликвоты PPP-РНК были имитированы, дефосфорилированы щелочной фосфатазой (FastAP; Fermentas) или модифицированы с использованием различных 5′-кэп-структур с использованием ScriptCap 2′-O-Methyltransferase и m7G Capping System (CellScript) в соответствии с инструкциями производителя. . Вкратце, 20 мкг образцов РНК денатурировали нагреванием при 65 ° C в течение 5 минут, охлаждали на льду, затем инкубировали с буфером ScriptCap в присутствии 500 мкМ GTP, 100 мкМ SAM, 100 мкМ 2′-O-метилтрансферазы ( VP39), 10 Ед фермента, блокирующего вирус осповакцины (VCE), и 40 Ед ингибитора РНКазы в течение 1 часа при 37 ° C.Кепированные РНК дополнительно обрабатывали FastAP для дефосфорилирования любой остаточной РРР-РНК, а затем очищали на колонке с использованием набора NucleoSpin RNA II (Macherey-Nagel). Чтобы добавить радиоактивно меченые метильные группы к транскрибированной in vitro РНК, 500 нг каждой РНК инкубировали с 100 ед. 2′-O-метилтрансферазы или 10 ед. VCE в 0,5 мкМ S-аденозилметионина и 1,4 мкМ S- [ 3 H- метил] -аденозилметионин (78 Ки / ммоль; Perkin-Elmer) в течение 1 ч при 37 ° C. Реакции очищали на колонках SigmaSpin Post-Reaction Clean-Up (Sigma), и элюаты смешивали с 2 мл сцинтилляционной жидкости Ultima Gold для измерения включения 3 H с помощью жидкостного сцинтилляционного счетчика Packard Tri-Carb (Perkin Elmer).
Получение и кэппирование химически синтезированных олигомеров РНК
Кэпированных олигорибонуклеотидов m7Gppp, соответствующих первым 22 нуклеотидам 5′-нетранслируемой области коронавируса тяжелого острого респираторного синдрома HKU-39849, получали путем добавления N7-метилированных кэп-структур к химически синтезированным олигомерам РНК с 3′-концевым амино-линкером С6. Олигомер трифосфорилированной РНК [PPP-r (AUAUUAGGUUUUUACCUACCC) -NH 2 ) и соответствующий 2’O-рибозо-метилированный олигомер РНК [PPP-r (AmUAUUAGGUUUUUACCUACCC) -NH9 были заказаны у компании Массачусетс, США) и закрывали, как описано выше, с помощью системы кэппинга m7G (CellScript).Затем олигомеры кэпированной РНК очищали с помощью ВЭЖХ, биотинилировали сложным эфиром биотин-N-гидроксисукцинимида (Эпицентр) в соответствии с инструкциями производителя и снова очищали с помощью ВЭЖХ. В качестве контроля мы использовали соответствующий 3′-концевой биотинилированный и очищенный с помощью ВЭЖХ олигорибонуклеотид, несущий 5′-гидроксильную группу [OH-r (AUAUUAGGUUUUUACCUACCCU) -биотин].
Идентификация и количественное определение РНК-связывающих белков
Для количественной очистки РНК-связывающих белков смолу с аффинным стрептавидином сначала инкубировали с 1 мкг аликвотами меченной биотином ОН-РНК, РРР-РНК, CAP-РНК, CAP0-РНК или CAP1-РНК (все 7SK-антисмысловые). в буфере TAP [50 мМ Трис, pH 7.5, 100 мМ NaCl, 5% (об. / Об.) Глицерина, 0,2% (об. / Об.) Nonidet-P40, 1,5 мМ MgCl 2 и коктейль ингибиторов протеазы (без ЭДТА, полный; Roche)] в присутствии Ингибитор РНКазы 40 U (Fermentas) в течение 60 мин при 4 ° C на вращающемся колесе. Затем контрольные или покрытые РНК шарики инкубировали с образцами лизата клеток HeLa по 2 мг в течение 60 мин, трижды промывали буфером TAP и дважды буфером TAP без Nonidet-P40 для удаления остаточного детергента. Для каждой РНК проводили три независимых аффинной очистки.Связанные белки дентатурировали путем инкубации в 6 М мочевине-2 М тиомочевине с 1 мМ DTT (Sigma) в течение 30 минут и алкилировали 5,5 мМ йодацетамидом (Sigma) в течение 20 минут. После переваривания 1 мкг LysC (WAKO Chemicals USA) при комнатной температуре в течение 3 часов суспензию разбавляли в 50 мМ бикарбонатном буфере аммония (pH 8). Гранулы удаляли фильтрованием через 96-луночные мультиэкранные фильтровальные планшеты (Millipore, MSBVN1210), и раствор белка расщепляли трипсином (Promega) в течение ночи при комнатной температуре.Пептиды очищали на наконечниках ступеней с помощью трех фильтровальных дисков C18 Empore (3M) и анализировали масс-спектрометрией, как описано ранее [36]. Вкратце, пептиды элюировали с наконечников ступеней и разделяли на колонке с обращенной фазой C18 (Reprosil-Pur 120 C18-AQ, 3 мкМ, 150 × 0,075 мм; Dr. Maisch), применяя градиент ацетонитрила от 5% до 30% в 0,5%. % уксусной кислоты при скорости потока 250 нл / мин в течение 95 минут с использованием системы EASY-nanoLC (Proxeon Biosystems). Система nanoLC была напрямую связана с источником ионов электрораспылением масс-спектрометра LTQ-Orbitrap XL (Thermo Fisher Scientific), работавшего в режиме зависимости от данных с полным сканированием в ячейке Orbitrap с разрешением 60000 с одновременным выделением и фрагментацией десять самых распространенных ионов в линейной ионной ловушке.
Аффинная очистка меченных люциферазой и рекомбинантных белков
N-конца Renilla меченых люциферазой белков временно экспрессировались в клетках 293T. Три микрограмма каждой конструкции трансфицировали в 6 × 10 6 клеток с использованием 9,6 мкл нанофектина (PAA Laboratories) в 10-сантиметровых чашках в соответствии с инструкциями производителя. Через 24 ч среду удаляли, и клетки лизировали ледяным буфером для лизиса ТАР. Аликвоту (10%) лизата удаляли для определения входной активности люциферазы.Остальное добавляли к гранулам стрептавидин-агарозы, покрытым 250 нг РНК, как описано выше, и инкубировали на вращающемся колесе при 4 ° C в течение 60 мин. Гранулы промывали трижды и ресуспендировали в 50 мкл буфера TAP. Активность люциферазы, присутствующую в суспензии и во входящем лизате, анализировали в реакционном буфере Renilla (100 мМ K 3 PO 4 , 500 мМ NaCl, 1 мМ EDTA, 25 мМ тиомочевина), содержащем 10 мкМ целентеразина в качестве субстрата. Реакции проводили в трех экземплярах, и результаты количественно оценивали с использованием ридера для микропланшетов Infinite 200 PRO (Tecan).Для аффинной очистки рекомбинантных белков с различными РНК от 50 до 250 нг биотинилированной РНК связывали со стрептавидин-агарозными гранулами в течение 60 минут при 4 ° C. Гранулы трижды промывали буфером TAP и инкубировали с рекомбинантными His-меченными белками в течение 60 минут при 4 ° C. После трех промывок шарики кипятили в буфере Лэммли в течение 10 минут при 95 ° C и подвергали SDS-PAGE и вестерн-блоттингу.
ОТ-ПЦР в реальном времени
Тотальную РНК выделяли с использованием набора NucleoSpin RNA II (Macherey-Nagel), включая расщепление ДНКазой на колонке, и от 200 до 500 нг РНК подвергали обратной транскрипции с помощью набора RevertAid H Minus First Strand cDNA Synthesis Kit (Fermentas).Затем уровни РНК количественно определяли с помощью ОТ-ПЦР в реальном времени с использованием набора QuantiTect SYBR Green RT-PCR (Qiagen) и системы обнаружения ПЦР в реальном времени CFX96 Touch (BioRad). Каждый цикл состоял из 15 секунд при 95 ° C, 30 секунд при 50 ° C и 30 секунд при 72 ° C с последующим анализом кривой плавления. Последовательности праймеров были следующими: Renilla, люцифераза (5′-CGAAAGTTTATGATCCAGAAC-3 ‘и 5′-AATCATAATAATTAATAAATG-3′), hCycB (5’-CAGCAAGTTCCATCGTGTCATCATCAAGG-3 ‘и 5’-GGAAGTC ‘-CCTTCACCAATGACTCCTATGAC-3′ и 5’-CAAGTTTACAGCCAAGATTCA-3 ‘), mIFN-β (5′-ATGGTGGTCCGAGCAGAGAT-3′ и 5’-CCACCACTCATTCTGAGGCA-3 ‘), ′ — GGGCCTCTCTTTCCAAAACAC-3 ′), 229E-N (5′-CAGTCAAATGGGCTGATGCA-3 ′ и 5′-AAAGGGCTATAAAGAGAATAAGGTATTCT-3 ′), mIfit1 (5′- CCATAGCG′GAGGTGATGAT-5′-CCATAGCG′GAGGT ′ 5′-AATCAGAAGAGGCAGCCATC-3 ′ и 5′-CATGGCTTCACTTGTGTTCC-3 ′), mIfit2 (5′-TCAGCACCTGCTTCATCCAA-3 ′ и 5′-CACCTTCGGTATGGCAACTT-3 ′ и ′ TGGTCATGTGCCGTTACAGG-3 ‘).
Эксперименты по вирусной инфекции в культуре клеток и in vivo
мышей C57BL / 6 были получены от Charles River Laboratories (Зульцфельд, Германия), и были описаны мыши Ifit1 — / — [16], [17]. Мышей содержали в индивидуально вентилируемых клетках и использовали в возрасте от 6 до 9 недель. Все эксперименты на животных проводились в соответствии с швейцарским федеральным законодательством о защите животных и с одобрения Комитета по изучению животных при кантональной ветеринарной службе (St.Галлен, Швейцария). Мышам дикого типа и Ifit1 — / — (любезно предоставленных Майклом Даймондом) внутрибрюшинно вводили 5000 бляшкообразующих единиц MHV. Титры вирусов в образцах селезенки, удаленной и замороженной через 48 часов после инфицирования, оценивали с помощью стандартного анализа бляшек на клетках L929. Макрофаги, происходящие из костного мозга, или фибробласты эмбрионов мыши (от 1 до 5 × 10 5 клеток) обрабатывали или не обрабатывали IFN-α и инфицировали указанными вирусами при множественности инфекции (MOI) 5.Для синхронизированного инфицирования клетки инфицировали вирусом на льду и через 1 час добавляли предварительно нагретую среду для выращивания DMEM. Для количественной оценки эффектов siRNA-опосредованного нокдауна IFIT1 аликвоты 10 5 клеток HeLa, которые были трансфицированы в течение 48 часов 15 пмоль siRNA и 500 нг экспрессионной плазмиды для человеческого APN с использованием реагента siRNA Prime (PAA Laboratories) в соответствии с инструкции производителя, были предварительно обработаны IFN-α, как указано, и инфицированы HCoV-229E при MOI 1 в течение 24 часов.
Импульсный СИЛАК и масс-спектрометрия
Для импульсного SILAC макрофаги мыши, меченные тяжелыми изотопами (см. Выше), лизировали в буфере для лизиса SDS (50 мМ Трис, pH 7,5, 4% додецилсульфат натрия). Затем лизат нагревали в течение 5 минут при 95 ° C, обрабатывали ультразвуком в течение 15 минут с помощью Bioruptor (Diagenode) и центрифугировали в течение 5 минут при 16000 × g при комнатной температуре. Концентрацию белка определяли с помощью анализа Лоури (DC Protein Assay, BioRAD), аликвоты по 50 мкг восстанавливали 10 мМ DTT в течение 30 минут, алкилировали 55 мМ IAA в течение 20 минут при комнатной температуре и осаждали 80% ацетоном в течение 3 минут. ч при −20 ° C.После центрифугирования в течение 15 минут при 16000 × g при 4 ° C осадки промывали 80% ацетоном, сушили в течение 30 минут при комнатной температуре и растворяли в 6 М мочевине-2 М тиомочевине. Белки расщепляли LysC и трипсином при комнатной температуре, а пептиды очищали на наконечниках предметных столов и анализировали с помощью ЖХ-МС / МС с использованием системы Easy nano LC, соединенной с масс-спектрометром Q Exactive (Thermo Fisher Scientific). Разделение пептидов было достигнуто на колонке с обращенной фазой C18 (Reprosil-Pur 120 C18-AQ, 1.9 мкМ, 200 × 0,075 мм; Доктор Майш), используя 95-минутный линейный градиент от 2 до 30% ацетонитрила в 0,1% муравьиной кислоте. Масс-спектрометр был настроен для запуска метода Top10 с полным сканированием с последующим выделением, HCD-фрагментацией и обнаружением десяти наиболее распространенных ионов за одно сканирование в ячейке Orbitrap.
Биоинформатический анализ
Необработанные данные масс-спектрометрии были обработаны с помощью программного обеспечения MaxQuant версий 1.2.7.4 и 1.3.0.5 [37] с использованием встроенной поисковой системы Andromeda для поиска протеомов человека и мыши (UniprotKB, выпуск 2012_01), содержащих прямые и обратные последовательности, и алгоритм количественного определения без меток, как описано ранее [36], [38].В MaxQuant карбамидометилирование было установлено как фиксированное, а окисление метионина и N-ацетилирование как переменные модификации, с использованием начального допуска по массе 6 ppm для иона-предшественника и 0,5 Да для ионов фрагмента. Для образцов SILAC множественность была установлена на 2, а Arg10 и Lys8 были установлены как параметры тяжелой метки. Результаты поиска были отфильтрованы с коэффициентом ложного обнаружения (FDR) 0,01 для идентификации пептидов и белков. Таблицы белков были отфильтрованы, чтобы исключить идентификацию из обратной базы данных и общие контаминанты.
При анализе данных масс-спектрометрии аффинных очисток РНК учитывались только белки, идентифицированные на основе по крайней мере двух пептидов и минимум трех событий количественного определения по крайней мере в одной экспериментальной группе. Значения интенсивности белка без метки количественного определения (LFQ) были преобразованы в логарифмически, а пропущенные значения заполнены путем вменения случайными числами, взятыми из нормального распределения, среднее значение и стандартное отклонение которых были выбраны для наилучшего моделирования низких значений численности. Значимые взаимодействия РНК с различными 5′-концевыми структурами были определены с помощью множественных t-критериев одинаковой дисперсии со статистикой частоты ложных открытий на основе перестановок [39].Мы выполнили 250 перестановок, и порог FDR был установлен от 0,02 до 0,1. Параметр S 0 был эмпирически установлен между 0,2 и 1, чтобы отделить фон от специально обогащенных взаимодействующих элементов.
Для анализа данных импульсных экспериментов SILAC мы использовали логарифмически преобразованные отношения тяжелых и легких белков. Для анализа рассматривались только белки с допустимыми значениями, которые нормализовались путем деления на медиану строки. Графики профиля были созданы с использованием интенсивностей LFQ для интенсивностей логарифмически трансформированных белков, меченных тяжелой меткой.Мы исключили белки, содержащие менее 10 действительных значений из всех 12 измерений, а пропущенные значения были заполнены путем вменения. Затем интенсивности LFQ нормализовали путем деления на медианное значение строки.
Результаты были построены с использованием R (www.R-project.org) и GraphPad Prism версии 5.02. Множественные выравнивания последовательностей получали с помощью ClustalW (http://www.ebi.ac.uk/Tools/msa/clustalw2/).
Структурное моделирование
Модель гомологии человеческого IFIT1 была получена с помощью MODELLER [40] с использованием рентгеновской структуры человеческого IFIT5 (4HOQ) в качестве структурной матрицы [20].Попарное выравнивание последовательностей было произведено с помощью ClustalW (http://www.ebi.ac.uk/Tools/msa/clustalw2/) и дополнительно уточнено с помощью MODELLERs align2d. IFIT1 и IFIT5 человека имеют примерно 75,6% сходства последовательностей, при этом 57,2% всех остатков идентичны. Объемы полостей в обеих структурах были рассчитаны в двухэтапном процессе методом прокатки зонда с использованием 3V [41]. Сначала для каждой структуры был рассчитан объем без растворителя с использованием радиуса зонда 1,5 Å (соответствует воде). Для расчета так называемых «объемов оболочки» использовался зонд большего размера, равный 5 Å.Объемы доступных для растворителя полостей были получены вычитанием каждого объема без растворителя из соответствующего объема оболочки.
Дополнительная информация
Рисунок S1.
Получение 5′-концевой модифицированной транскрибированной in vitro РНК. ( a ) Схематический обзор синтеза биотинилированной РНК, использованной в этом исследовании. 5′-трифосфорилированная (PPP-) 7SK-антисмысловая РНК, полученная путем транскрипции in vitro полимеразой SP6, была ферментативно модифицирована на 5′-конце путем инкубации с щелочной фосфатазой (AP) для удаления 5′-фосфатов (OH-РНК) с рекомбинантным вирусом осповакцины. кэпирующий фермент (VCE) для получения неметилированной кэпированной РНК (CAP-RNA), с VCE в присутствии S-аденозилметионина (SAM) для генерации N7-метилированной кэпированной РНК (CAP0-RNA) или с VCE и рекомбинантным вирусом осповакцины 2 ‘O-метилтрансфераза (VP39) в присутствии SAM для образования N7-метилированной кэпированной РНК, метилированной в положении 2’O первой рибозы (CAP1-РНК) [43], [44].( b ) Изображение геля агарозы, показывающее 200 нг транскрибированной in vitro биотинилированной РНК после ферментативной обработки, описанной в ( a ). ( c ) Оценка эффективности N7- и 2’O-метилирования рекомбинантных ферментов вируса осповакцины. Кепированные РНК, полученные как в ( a ), инкубировали либо с VCE, либо с VP39 в присутствии SAM, меченного 3 H, и эффективность включения измеряли сцинтилляционным счетом. 3 H-меченные метильные группы были перенесены из SAM только в том случае, если РНК не была ранее метилирована (N7-метилирование CAP-РНК и 2’O-метилирование CAP0-РНК), что показывает, что метилирование РНК как VCE, так и VP39 оказался максимально эффективным.
https://doi.org/10.1371/journal.ppat.1003663.s001
(TIF)
Рисунок S2.
Аффинная очистка РНК из лизатов клеток HeLa. ( a ) Тепловая карта всех белков, идентифицированных при аффинной очистке РНК из лизатов клеток HeLa. Иерархическая кластеризация белков выполнялась на основе логарифмических интенсивностей белков LFQ с использованием евклидовых расстояний. Цветовой код представляет интенсивности LFQ в цветах радуги (см. Цветовую шкалу). ( b ) Тепловая карта, показывающая иерархическую кластеризацию (евклидовы расстояния) интеракторов, которые были значительно обогащены (см. Материалы и методы) фракциями, связанными по крайней мере одной РНК с модифицированной 5′-концевой структурой (по сравнению с ОН-РНК).График показывает средние значения логарифмических интенсивностей LFQ, преобразованных в Z-оценку. Синие цвета указывают на Z-оценку <0, красные цвета указывают на Z-оценку> 0, белые указывают на Z-оценку = 0. Порог насыщения установлен на -2,25 и +2,25. Звездочки обозначают комплекс IFIT. ( c ) Графики вулканов, показывающие обогащение (соотношение интенсивностей белка LFQ; ось x) и значения p (t-критерий; ось y) CAP1-РНК к CAP-РНК. Данные взяты из трех независимых аффинных очисток. Существенно обогащенные интеракторы (см. Материалы и методы) отделены от фоновых белков (синие точки) гиперболической кривой (пунктирная линия).Среди значимых взаимодействующих выделены белки IFIT и FTSJD2 (красный).
https://doi.org/10.1371/journal.ppat.1003663.s002
(TIF)
Рисунок S3.
Аффинная очистка РНК из лизатов фибробластов эмбрионов мыши. ( a – b ) Как на рис. S2, но показаны белки, идентифицированные при аффинной очистке РНК из фибробластов эмбрионов мыши. В ( b ) порог насыщения установлен на -1. 5 и +1. 5. Звездочкой обозначен комплекс Ифит.
https://doi.org/10.1371/journal.ppat.1003663.s003
(TIF)
Рисунок S4.
Характеристика мышиного комплекса IFIT. ( a ) Экспрессия генов Ifit в эмбриональных фибробластах мыши (MEF) дикого типа (Ifit1 + / + ) и с дефицитом Ifit1 (Ifit1 — / — ). MEF оставляли без лечения, обрабатывали 1000 ед / мл IFN-α или инфицировали вирусом лихорадки Рифт-Валли Clone13 или мутантной версией вируса везикулярного стоматита (VSV-M2) при множественности инфицирования 1 или 0.01 соответственно. Спустя шестнадцать часов РНК анализировали с помощью количественной ОТ-ПЦР на mIfit1, mIfit1c, mIfit2 и mIfit3. В каждом случае показан один репрезентативный эксперимент из трех со средними значениями ± стандартное отклонение после нормализации к мРНК ТАТА-связывающего белка (ТВР). ( b ) Тепловая карта выбранных белков, идентифицированных при аффинной очистке РНК из клеточных лизатов MEF Ifit1 + / + и Ifit1 — / — . График показывает средние значения логарифмически трансформированных количественных интенсивностей белков без метки в цветах радуги (см. Цветовую шкалу).(c ) Сопоставление белков IFIT мыши и человека с использованием ClustalW. ( d ) Матрица, показывающая аминокислотное сходство (на основе сопоставления ClustalW) всех белков IFIT мыши и человека. Процентное сходство обозначается цветом от белого до красного, а точное сходство показано в каждом элементе матрицы.
https://doi.org/10.1371/journal.ppat.1003663.s004
(TIF)
Рисунок S5.
Сравнение полостей связывания РНК IFIT5 и IFIT1. Показаны участки представлений поверхностей доступных для растворителя поверхностей IFIT5 (вверху) и IFIT1 (внизу), с PPP-РНК, связанной, как в IFIT5 (представление стержня, наложенное на IFIT1), и соответствующие объемы полости V, рассчитанные, как описано в материалах и методах. В наших расчетах основная полость связывания РНК в IFIT5 имеет объем 11881 Å 3 . Расчетный объем соответствующей полости моделируемого IFIT1 при 12627 Å 3 примерно на 700 Å 3 больше.
https://doi.org/10.1371/journal.ppat.1003663.s005
(TIF)
Рисунок S6.
Индукция интерферона-β в клетках мышей дикого типа и с дефицитом Ifit1. Стимулированные интерфероном макрофаги костного мозга (MΦs) от мышей C57 / BL6 (Ifit1 + / + ) или мышей с дефицитом Ifit1 (Ifit1 — / — ) не получали лечения или инфицировали MHV дикого типа (WT ), 2’O-метилтрансфераза-дефицитный MHV (DA) или вирус Сендай (SeV). Двенадцать часов спустя тотальную РНК собирали и анализировали с помощью количественной ОТ-ПЦР на мРНК интерферона β (IFN-β).Данные трех независимых экспериментов, показывающие кратное изменение по сравнению с необработанными клетками (среднее ± стандартное отклонение) после нормализации к мРНК ТАТА-связывающего белка (ТВР).
https://doi.org/10.1371/journal.ppat.1003663.s006
(TIF)
Рисунок S7.
Профили трансляции отдельных белков в макрофагах, инфицированных MHV. Профили трансляции, основанные на импульсном SILAC макрофагов от мышей C75 / BL6 (Ifit1 + / + ) и с дефицитом Ifit1 (Ifit1 — / — ), инфицированных MHV дикого типа (WT) или 2’O-метилтрансферазой MHV (DA), как показано на рис.5. График профиля показывает нормализованные интенсивности LFQ тяжелых белков, представляющие общее количество 451 белка, помеченного в течение 2-часового периода импульса. Данные показывают среднюю интенсивность LFQ из трех независимых повторов. Выбранные профили окрашены и представляют белки MHV и клеточные белки, участвующие в иммунных ответах.
https://doi.org/10.1371/journal.ppat.1003663.s007
(TIF)
Таблица S1.
Количественные данные МС по аффинной очистке РНК с лизатами клеток HeLa. Белки, идентифицированные с помощью LC-MS / MS из лизатов клеток HeLa после аффинной очистки с помощью различных РНК-приманок. Таблица содержит логарифмически преобразованные и условно вычисленные безметки интенсивности количественного определения (LFQ) всех идентифицированных белков. Показаны значительно обогащенные белки, значения p и средние отличия от анализов, основанных на t-тесте.
https://doi.org/10.1371/journal.ppat.1003663.s008
(XLSX)
Таблица S2.
Количественные данные МС по аффинной очистке РНК с лизатами MEF. Белки, идентифицированные с помощью LC-MS / MS из лизатов фибробластов эмбрионов мыши (MEF) после аффинной очистки с помощью различных РНК-приманок. Таблица содержит логарифмически преобразованные и условно вычисленные безметки интенсивности количественного определения (LFQ) всех идентифицированных белков. Показаны значительно обогащенные белки, значения p и средние отличия от анализов, основанных на t-тесте.
https://doi.org/10.1371/journal.ppat.1003663.s009
(XLSX)
Благодарности
Мы благодарим Маттиаса Манна, Феликса Мейснера, Корбиниана Майера, Игоря Парона, Габи Сова, Фалька Баттера, Юргена Кокса, Бернд Хааса и Стефана Юбеля (MPI of Biochemistry Core Facility) за техническую поддержку, Альбрехта фон Брунна за плазмиды Lumier и Елене Конти за научный вклад и критическое прочтение рукописи.Мы также хотим поблагодарить Giulio Superti-Furga за предоставленные реагенты.
Вклад авторов
Задумал и спроектировал эксперименты: MH PH VT AP. Проведены эксперименты: MH PH LL CH AM EK CGC AP. Проанализированы данные: MH PH CB CHE VT AP. Предоставленные реагенты / материалы / инструменты анализа: JZ VT. Написал статью: MH PH AP.
Список литературы
- 1. Versteeg GA, Garcia-Sastre A (2010) Вирусные уловки для блокировки системы интерферона типа I. Curr Opin Microbiol 13: 508–516.
- 2. Ивасаки А., Меджитов Р. (2010) Регулирование адаптивного иммунитета с помощью врожденной иммунной системы. Наука 327: 291–295.
- 3. Sadler AJ, Williams BR (2008) Интерферон-индуцируемые противовирусные эффекторы. Nat Rev Immunol 8: 559–568.
- 4. Хорнунг В., Латц Э. (2010) Распознавание внутриклеточной ДНК. Нат Рев Иммунол 10: 123–130.
- 5. Като Х., Такахаси К., Фуджита Т (2011) RIG-I-подобные рецепторы: цитоплазматические сенсоры для несамостоятельной РНК.Immunol Rev 243: 91–98.
- 6. Гебауэр Ф., Хентце М.В. (2004) Молекулярные механизмы трансляционного контроля. Nat Rev Mol Cell Biol 5: 827–835.
- 7. Topisirovic I, Svitkin YV, Sonenberg N, Shatkin AJ (2011) Cap и cap-связывающие белки в контроле экспрессии генов. Wiley Interdiscip Rev RNA 2: 277–298.
- 8. Pichlmair A, Reis e Sousa C. (2007) Врожденное распознавание вирусов. Иммунитет 27: 370–383.
- 9. Decroly E, Ferron F, Lescar J, Canard B (2012) Традиционные и нетрадиционные механизмы кепки вирусной мРНК.Nat Rev Microbiol 10: 51–65.
- 10. Colonno RJ, Stone HO (1976) мРНК вируса болезни Ньюкасла не содержит 2′-O-метилированных нуклеотидов. Природа 261: 611–614.
- 11. Зуст Р., Сервантес-Барраган Л., Хабджан М., Майер Р., Нойман Б. В. и др. (2011) 2′-O-метилирование рибозы обеспечивает молекулярную сигнатуру для различения собственной и чужой мРНК, зависящей от сенсора РНК Mda5. Нат Иммунол 12: 137–143.
- 12. Хорнунг В., Эллегаст Дж, Ким С., Брзозка К., Юнг А. и др.(2006) 5′-Трифосфатная РНК является лигандом для RIG-I. Наука 314: 994–997.
- 13. Пихлмайр А., Шульц О., Тан С. П., Наслунд Т. И., Лильестром П. и др. (2006) RIG-I-опосредованные противовирусные ответы на одноцепочечную РНК, несущую 5′-фосфаты. Наука 314: 997–1001.
- 14. Като Х., Такеучи О, Микамо-Сато Э., Хираи Р., Кавай Т. и др. (2008) Зависимое от длины распознавание двухцепочечных рибонуклеиновых кислот индуцируемым ретиноевой кислотой геном-I и геном 5, связанным с дифференцировкой меланомы.J Exp Med 205: 1601–1610.
- 15. Diamond MS, Farzan M (2013) Широкий спектр противовирусных функций белков IFIT и IFITM. Nat Rev Immunol 13: 46–57.
- 16. Пихлмайр А., Лассниг С., Эберле К.А., Горна М.В., Бауманн С.Л. и др. (2011) IFIT1 — это противовирусный белок, распознающий 5′-трифосфатную РНК. Нат Иммунол 12: 624–630.
- 17. Даффис С., Шреттер К.Дж., Шривер Дж., Ли Дж., Юн С. и др. (2010) 2′-O-метилирование кэпа вирусной мРНК позволяет избежать ограничения хозяина членами семейства IFIT.Природа 468: 452–456.
- 18. Фенстерл В., Ветцель Дж. Л., Рамачандран С., Огино Т., Штолман С.А. и др. (2012) Интерферон-индуцированный Ifit2 / ISG54 защищает мышей от летального нейропатогенеза VSV. PLoS Pathog 8: e1002712.
- 19. Szretter KJ, Daniels BP, Cho H, Gainey MD, Yokoyama WM, et al. (2012) 2′-O-метилирование кэпа вирусной мРНК вирусом Западного Нила позволяет избежать ifit1-зависимых и -независимых механизмов ограничения хозяина in vivo. PLoS Pathog 8: e1002698.
- 20.Abbas YM, Pichlmair A, Gorna MW, Superti-Furga G, Nagar B (2013) Структурная основа распознавания вирусной 5′-PPP-РНК белками IFIT человека. Природа 494: 60–64.
- 21. Шапира С.Д., Гат-Викс И., Шум Б.О., Дрикот А, де Грейс М.М. и др. (2009) Физическая и регуляторная карта взаимодействий «хозяин-грипп» показывает пути заражения h2N1. Ячейка 139: 1255–1267.
- 22. Furuichi Y, Shatkin AJ (2001) Caps on Eukaryotic mRNAs. eLS
- 23. Schwanhausser B, Busse D, Li N, Dittmar G, Schuchhardt J, et al.(2011) Глобальная количественная оценка контроля экспрессии генов млекопитающих. Природа 473: 337–342.
- 24. Saha S, Sugumar P, Bhandari P, Rangarajan PN (2006) Идентификация генов, индуцируемых вирусом японского энцефалита, в мозге мышей и характеристика GARG39 / IFIT2 как белка, связанного с микротрубочками. J Gen Virol 87: 3285–3289.
- 25. Li J, Fontaine-Rodriguez EC, Whelan SP (2005) Аминокислотные остатки в консервативном домене VI большого белка полимеразы вируса везикулярного стоматита, необходимого для активности мРНК cap-метилтрансферазы.Дж. Вирол 79: 13373–13384.
- 26. Ли Дж., Ван Дж. Т., Уилан С. П. (2006) Уникальная стратегия метилирования кэпа мРНК, используемая вирусом везикулярного стоматита. Proc Natl Acad Sci U S A 103: 8493–8498.
- 27. Морита М., Лер Л.В., Фабиан М.Р., Сиддики Н., Муллин М. и др. (2012) Новый репрессорный комплекс трансляции 4EHP-GIGYF2 необходим для развития млекопитающих. Mol Cell Biol 32: 3585–3593.
- 28. Чо П.Ф., Пулин Ф., Чо-Парк Ю.А., Чо-Парк И.Б., Чикоин Д.Д. и др.(2005) Новая парадигма для контроля трансляции: ингибирование посредством связывания 5′-3 ‘мРНК с помощью Bicoid и родственного eIF4E 4EHP. Ячейка 121: 411–423.
- 29. Sripati CE, Groner Y, Warner JR (1976) Метилированные, заблокированные 5′-концы мРНК дрожжей. J Biol Chem 251: 2898–2904.
- 30. Циммерн Д. (1975) 5′-концевая группа РНК вируса табачной мозаики — это m7G5 ‘ppp5’ Gp. Nucleic Acids Res 2: 1189–1201.
- 31. Bouloy M, Plotch SJ, Krug RM (1980) И 7-метильная, и 2′-O-метильная группы в кэпе мРНК сильно влияют на ее способность действовать как праймер для транскрипции РНК вируса гриппа.Proc Natl Acad Sci U S. A 77: 3952–3956.
- 32. Фехтер П., Браунли Г.Г. (2005) Распознавание кэп-структур мРНК вирусными и клеточными белками. J Gen Virol 86: 1239–1249.
- 33. Ruigrok RW, Crepin T, Hart DJ, Cusack S (2010) К пониманию атомарного разрешения механизма репликации вируса гриппа. Curr Opin Struct Biol 20: 104–113.
- 34. Мюллер Р., Салуццо Дж. Ф., Лопес Н., Драйер Т., Турелл М. и др. (1995) Характеристика клона 13, естественно аттенуированного авирулентного изолята вируса лихорадки долины Рифт, который изменен в небольшом сегменте.Am J Trop Med Hyg 53: 405–411.
- 35. Стойдл Д.Ф., Личти Б.Д., тенОВер Б.Р., Патерсон Дж.М., Пауэр А.Т. и др. (2003) Штаммы VSV с дефектами в их способности отключать врожденный иммунитет являются мощными системными противораковыми средствами. Cancer Cell 4: 263–275.
- 36. Hubner NC, Bird AW, Cox J, Splettstoesser B, Bandilla P и др. (2010) Количественная протеомика в сочетании с BAC TransgeneOmics выявляет белковые взаимодействия in vivo. J Cell Biol 189: 739–754.
- 37.Cox J, Mann M (2008) MaxQuant обеспечивает высокую скорость идентификации пептидов, индивидуализированную точность масс в диапазоне p.p.b. и количественное определение белка в масштабе всего протеома. Nat Biotechnol 26: 1367–1372.
- 38. Любер К.А., Кокс Дж., Лаутербах Х., Фанке Б., Зельбах М. и др. (2010) Количественная протеомика выявляет специфическое для подмножества вирусное распознавание дендритными клетками. Иммунитет 32: 279–289.
- 39. Тушер В.Г., Тибширани Р., Чу Г. (2001) Анализ значимости микроматриц, применяемых к отклику на ионизирующее излучение.Proc Natl Acad Sci U S A 98: 5116–5121.
- 40. Эсвар Н., Уэбб Б., Марти-Реном М.А., Мадхусудхан М.С., Эрамиан Д. и др. (2006) Сравнительное моделирование структуры белков с помощью Modeller. Curr Protoc Bioinformatics Глава 5: Раздел 5 6.
- 41. Voss NR, Gerstein M (2010) 3V: вычислитель и экстрактор объема полости, канала и щели. Nucleic Acids Res 38: W555–562.
- 42. Liu SY, Sanchez DJ, Aliyari R, Lu S, Cheng G (2012) Систематическая идентификация противовирусных факторов, индуцированных интерфероном типа I и типа II.Proc Natl Acad Sci U S A 109: 4239–4244.
- 43. Мартин С.А., Мосс Б. (1975) Модификация РНК мРНК гуанилилтрансферазой и мРНК (гуанин-7-) метилтрансферазой из вирионов коровьей оспы. J Biol Chem 250: 9330–9335.
- 44. Barbosa E, Moss B (1978) мРНК (нуклеозид-2 ‘-) — метилтрансфераза из вируса коровьей оспы. Характеристики и субстратная специфичность. J Biol Chem 253: 7698–7702.
TET-опосредованное окисление 5-метилцитозина в тРНК способствует трансляции
https: // doi.org / 10.1074 / jbc.RA120.014226Get rights and contentОкисление 5-метилцитозина (5mC) в ДНК семейством ферментов с транслокацией десять-одиннадцать (TET) необходимо для регуляции генов у млекопитающих. Совсем недавно появились доказательства в поддержку биологической функции TET-опосредованного окисления m 5 C в матричной РНК. Здесь мы описываем ранее не охарактеризованную роль TET-опосредованного окисления m 5 C в транспортной РНК (тРНК). Мы обнаружили, что TET-опосредованный продукт окисления 5-гидроксилметилцитозин (hm 5 C) специфически обогащен тРНК внутри клеток и что окислительную активность TET2 на m 5 C в тРНК можно легко наблюдать in vitro .Мы также наблюдали, что уровни hm 5 C в тРНК были значительно снижены в эмбриональных стволовых клетках мыши (mESC) Tet2 KO по сравнению с mESC дикого типа. В свою очередь, индуцированная экспрессия каталитического домена TET2 привела к очевидному увеличению hm 5 C и снижению m 5 C в тРНК по сравнению с неиндуцированными клетками. Поразительно, но мы также показали, что TET2-обусловленное окисление m 5 C в тРНК способствует трансляции in vitro . Эти результаты предполагают, что TET2 может влиять на трансляцию посредством воздействия на метилирование тРНК и раскрывает неожиданную роль ферментов TET в регуляции множественных узлов центральной догмы.

